
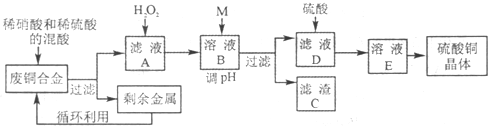
| Fe3+ | Fe2+ | Cu2+ | Al3+ | |
| 开始沉淀时pH | 2.2 | 7.5 | 5.2 | 3.7 |
| 完全沉淀时pH | 3.2 | 9.0 | 6.7 | 4.7 |


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
| A、使用酒精灯时,洒出的酒精在桌子上燃烧起来,立即用水扑灭 |
| B、在做乙醇与乙酸反应制乙酸乙酯的实验中,要在混合液中加碎瓷片防暴沸 |
| C、蒸发结晶食盐溶液时,当有较多晶体析出时就停止加热 |
| D、过滤时,滤液低于滤纸边缘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
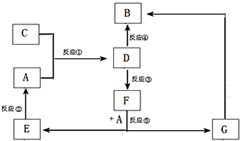 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液.
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液.| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 |
(用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:
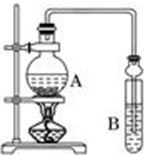 已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH;
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH;| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.5 | 78.3 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
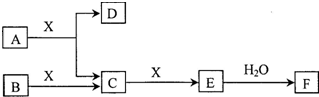 由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如图所示(某些产物已略去):
由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如图所示(某些产物已略去):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度 |
| B、Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
| C、电解精炼铜时,阳极质量每减少32g,阴极析出的铜质量也为32g |
| D、用HNO2溶液做导电性实验,灯光较暗,说明HNO2是弱电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com