
| A. | 离子半径:Cl->Mg2+>Na+ | B. | 热稳定性:HF>H2O>H2S | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 非金属性:Cl>Br>I |
分析 A.核外电子排布相同时,原子序数越大,半径越小;
B.非金属性越强,气态氢化物越稳定;
C.非金属性越强,其最高价氧化物对应水化物酸性越强;
D.同一主族,原子序数越大,非金属性越弱.
解答 解:A.核外电子排布相同时,原子序数越大,离子半径越小,则离子半径:Mg2+<Na+,故A错误;
B.非金属性越强,气态氢化物越稳定,非金属性:F>O>S,则热稳定性:HF>H2O>H2S,故B正确;
C.由于非金属性Cl>S>P,故酸性HClO4>H2SO4>H3PO4,故C正确;
D.同一主族,原子序数越大,非金属性越弱,故非金属性:Cl>Br>I,故D正确;
故选A.
点评 本题考查元素的金属性、非金属性的递变规律、半径比较,题目难度不大,掌握规律以及比较方法即可完成.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
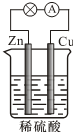
| A. | 负极的反应式为2H++2e-═H2↑ | |
| B. | 电子由Zn经外电路流向Cu,再经硫酸溶液流回Zn | |
| C. | 反应一段时间后,溶液的酸性增强 | |
| D. | 硫酸既提供反应物,又起导电作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
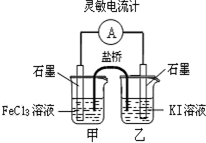
| A. | 反应开始时,甲中石墨电极上Fe3+被还原 | |
| B. | 反应开始时,乙中电极反应为2I--2e-=I2 | |
| C. | 电流计读数为零时,反应达到化学平衡状态 | |
| D. | 平衡时甲中溶入FeCl2固体后,电流计读数为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ①②⑤ | C. | ③⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40gSiC晶体中含有2NA个Si-C共价键 | |
| B. | 标准状况下,22.4LCl2作为反应物参加反应时,转移的电子数一定为2NA | |
| C. | 1mol的CH≡CH中,所含σ键的总数为3NA | |
| D. | 常温常压下,100mL0.5mol/L的醋酸溶液中,醋酸根离子的数目为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出.不能说明钠的金属性比铜弱 | |
| B. | 用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝.说明氯元素的非金属性比碘元素强 | |
| C. | 把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出.说明Cl的非金属性比S强 | |
| D. | 将0.1 mol Na、Mg、Al分别与足量稀盐酸反应,除共同产生H2外,还分别生成了NaCl、MgCl2、AlCl3,金属失去的电子数分别为0.1 mol、0.2 mol、0.3 mol.说明这三种金属的活泼性为:Al>Mg>Na |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 16g | B. | 8g | C. | 40g | D. | 0.2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com