
| A、①和② | B、②和③ |
| C、①和③ | D、只有③ |


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
 在T℃时,在容积为0.5L的密闭容器中发生如下反应:mA(g)+nB(g)?pC(g)+qD(s),△H<0(m、n、p、q为最简整数比).A、B、C、D物质的量的变化如图所示:
在T℃时,在容积为0.5L的密闭容器中发生如下反应:mA(g)+nB(g)?pC(g)+qD(s),△H<0(m、n、p、q为最简整数比).A、B、C、D物质的量的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能消毒杀菌又能净水 |
| B、高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| C、低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
| D、“光化学烟雾”、“臭氧空洞”、“硝酸酸雨”的形成都与氮氧化合物有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
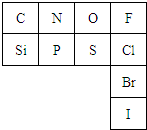 元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:
元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com