
【题目】工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解后,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.回答下列问题:
(1)为除去溶液中的Fe2+,可先加入______(填化学式)将Fe2+氧化为Fe3+,反应的离子方程式为__________,然后再加入适量的__________调整溶液的pH到______,使Fe3+转化为Fe(OH)3。
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全,设溶液中CuSO4的浓度为3molL-1,则Cu(OH)2开始沉淀时溶液的pH为______,Fe3+完全沉淀时溶液的pH为______,通过计算确定上述方案______ (填“可行”或“不可行”)。
【答案】 H2O2 2Fe2++H2O2+2H+==2Fe3++2H2O CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3 3~4 4 3 可行
【解析】试题分析:本题以粗制CuO粉末制取纯净的胆矾晶体为载体,考查物质的分离提纯,溶度积的计算。
(1)由于pH![]() 9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH
9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH![]() 6.4时,Cu2+以Cu(OH)2的形式完全沉淀;除去溶液中的Fe2+,先加入氧化剂将Fe2+氧化,为了不引入杂质,加入的氧化剂选H2O2,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀,为了不引入杂质,然后加入适量的CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3)调整溶液的pH至3~4,使Fe3+完全转化为Fe(OH)3沉淀。
6.4时,Cu2+以Cu(OH)2的形式完全沉淀;除去溶液中的Fe2+,先加入氧化剂将Fe2+氧化,为了不引入杂质,加入的氧化剂选H2O2,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀,为了不引入杂质,然后加入适量的CuO(或Cu(OH)2、CuCO3、Cu2(OH)2CO3)调整溶液的pH至3~4,使Fe3+完全转化为Fe(OH)3沉淀。
(2)常温下,Cu(OH)2开始沉淀时c(Cu2+)·c2(OH-)=Ksp[Cu(OH)2]=3![]() 10-20,c(OH-)=
10-20,c(OH-)=![]() =1
=1![]() 10-10mol/L,c(H+)=1
10-10mol/L,c(H+)=1![]() 10-4mol/L,Cu(OH)2开始沉淀时溶液的pH=4。Fe3+完全沉淀时c(Fe3+)
10-4mol/L,Cu(OH)2开始沉淀时溶液的pH=4。Fe3+完全沉淀时c(Fe3+)![]() 1
1![]() 10-5mol/L,c(Fe3+)·c3(OH-)=Ksp[Fe(OH)3]=1
10-5mol/L,c(Fe3+)·c3(OH-)=Ksp[Fe(OH)3]=1![]() 10-38,c(OH-)=
10-38,c(OH-)=![]() =1
=1![]() 10-11mol/L,c(H+)=1
10-11mol/L,c(H+)=1![]() 10-3mol/L,Fe3+完全沉淀时溶液的pH=3。根据计算结果知上述方案可行。
10-3mol/L,Fe3+完全沉淀时溶液的pH=3。根据计算结果知上述方案可行。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.把煤粉碎了再燃烧可以提高煤的燃烧效率
B.增加炼铁高炉的高度可以降低尾气中CO的含量
C.无论加入正催化剂还是加入负催化剂都能大大提高化学反应速率
D.用完的电池可以随意地丢弃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂(Pt)可以和很多化合物形成配合物,生产生活中有重要的用途。
(1)铂和氨水可以形成配合物。可用于提取铂。氨水中各元素的第一电离能由大到小的顺序___。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体,科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①C1-的核外电子排布式为_______。
②吡啶分子是大体积平面配体,其结构简式为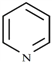 ,吡啶分子中氮原子的轨道杂化方式是_____,分子中的大π键可用符号
,吡啶分子中氮原子的轨道杂化方式是_____,分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π鍵的电子数,则吡啶中的大π键应表示为_____;1mol吡啶中含有σ键的数目为________
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π鍵的电子数,则吡啶中的大π键应表示为_____;1mol吡啶中含有σ键的数目为________
③二氯二吡啶合铂分子中存在的微粒间作用力有_____(填字母)。
a.离子健 b.配位键c.金属键 d.非极性键e.氢键f.极性键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。简述理由_____________。
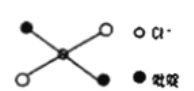
⑤反式二氯二吡啶合铂分子结构如图所示,该分子是_____分子(其“极性”或“非极性”)。
(3)富勒烯C60能够与Pt结合形成一系列络合物。富勒烯(C60)的结构如图所示,C60属于____晶体;C60分子中五元环与六元环的数目比为__________。
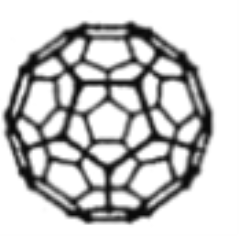
(已知简单多面体的顶点数V、棱数E及面数F间有如下关系:V-E+F=2)。
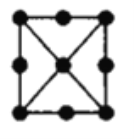
(4)金属铂立方晶胞的二维投影图如图所示。若金属铂的密度dg/cm3,则晶胞参数a=___nm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
I.工业生产精细化工产品乙二醛(OHC-CHO)
(1)乙醇(CH3CH2OH)液相硝酸氧化法:在Cu(NO3)2催化下,用稀硝酸氧化乙醇制取乙二醛,此反应的化学方程式为_______________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点____________。
(2)乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g) ![]() 2H2O(g)ΔH=-484kJ/mol,化学平衡常数为K1
2H2O(g)ΔH=-484kJ/mol,化学平衡常数为K1
OHC-CHO(g)+2H2(g) ![]() HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) ![]() OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
Ⅱ.CO2的综合利用
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
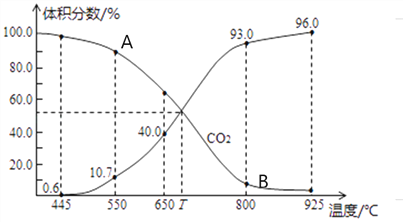
a.反应达平衡状态时,混合气体的平均相对分子质量保持不变
b.A点的正反应速率比B点正反应速率小
C.550℃时,若充入氦气,则V正、V逆均减小,平衡不移动
d.T℃时,反应达平衡后CO2的转化率为66.7%
e. T℃时,若再充入1molCO2和1molCO,平衡不移动
(4)氨气、CO2在一定条件下可合成尿素,其反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
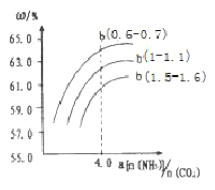
①b应控制在______
a.1.5-1.6b.1-1.1c.0.6-0.7
②a应控制在4.0的理由是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在正规化学试卷的开始处总有“可能用到的相对原子质量”一项,如H:1 C:12 Cl:35.5 S:32 Cu:64等.请问这些数值准确的说法应该是( )
A.某种核素的相对原子质量
B.某种核素的近似相对原子质量
C.某种元素的平均相对原子质量
D.某种元素的平均相对原子质量的近似值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。HA和HB的1L溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是
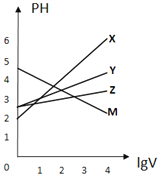
A. 相同条件下,对于c(R-)/[c(HR)·c(OH-)]的值(R代表A或B),一定存在HA>HB
B. 常温下pH:NaA溶液>NaB溶液
C. X是HA,M是HB
D. 若常温下浓度均为0.1mol/L的NaA和HA的溶液等体积混合,则c(A-)+c(HA)=0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验:

(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为__________________,反应前两电极质量相等,一段时间后,两电极质量相差15g,导线中通过__mol电子.
(2)如图1,其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极的电极反应式为___________________________________,这是由于NH4Cl溶液显____性,用离子方程式表示溶液显此性的原因__________________________________________
(3)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成∩型,则乙装置中石墨电极(1)为__极,甲装置中铜电极上电极反应式为_____

(4)如图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质量增重1.28g,则此时溶液的pH为__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)储氢纳米碳管的研究成功体现了科技的进步,但用电孤法合成的碳纳米管常伴有大量的杂质-碳纳米颗粒,可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7 + 8H2SO4= 3CO2 + 2K2SO4+ 2Cr2(SO4)3 + 8H2O
①请用双线桥法标出电子转移方向和数目__________________________________
②上述反应中氧化剂是___________________(填化学式)。
(2)按如图所示操作,充分反应后:

①Ⅰ中发生反应的离子方程式为_________________________________________
②结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对某葡萄酒中SO2的含量进行检测,按下图连接好仪器。回答下列问题:

Ⅰ.样品蒸馏
取20.00mL样品和250 mL水置于仪器A中,仪器B是去掉塞子的碘量瓶,向其中装人25mL 乙酸铅溶液,然后向仪器A中加入10 mL盐酸,立即盖塞蒸馏;当碘量瓶中的液体约200 mL时,将插入碘量瓶液面下的导管向上提起并将导管置于液面上方1cm 处,再蒸馏2min左右;最后用少量蒸馏水冲洗碘量瓶中的导管,并将冲洗液并入碘量瓶中。同时做空白实验(即不加样品情况下按同法操作,防止实验误差)。
已知:SO2+H2O+Pb(CH3COO)2=PbSO3↓+2CH3COOH。
(1)仪器A 的名称是_________________ 。
(2)实验中使用的碘量瓶最适宜的规格是_________ (填标号)。
a.100 mL b.250 mL c.500 mL d.1000 mL
(3)如果实验最后未用少量蒸馏水冲洗碘量瓶中的导管,会导致测定结果__________(填“偏高”“ 偏低”或“不影响”)。
Ⅱ.滴定操作
向取下的碘量瓶中加入10 mL盐酸和1mL淀粉溶液,摇匀后用0.01mol·L-1的碘标准溶液滴定,记录消耗的碘标准溶液的体积为V( 单位为mL)。
(4)滴定终点的现象是_____________________,该滴定反应的离子方程式是______________。
Ⅲ.结果分析
(5)甲组4 次实验测得V分别为
实验 | 1 | 2 | 3 | 4 |
V/mL | 9.98 | 12.00 | 10.02 | 10.00 |
据此可计算此葡萄酒中SO2的含量为_______mg·L-1
乙组认为甲组实验不严谨,可能会有误差,因为甲组未做_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com