
【题目】H是一种香料,可用如图的设计方案合成。

已知:①在一定条件下,有机物有下列转化关系:
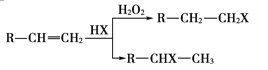 (X为卤素原子)
(X为卤素原子)
②烃A和等物质的量的HCl在不同的条件下发生加成反应,既可以生成只含有一个甲基的B,也可以生成含有两个甲基的F。
(1)D的结构简式为__。
(2)写出D与银氨溶液反应的化学反应方程式___。
(3)A→B和F→G的化学反应类型为___。
(4)E+G→H的化学反应方程式是___。
(5)H有多种同分异构体,其中含有一个羧基,且其烃基上一氯代物有两种的是___(用结构简式表示)。
【答案】CH3CH2CHO CH3CH2CHO+2Ag(NH3)2OH![]() CH3CH2COONH4+2Ag↓+3NH3+H2O 取代反应 CH3CH2COOH+ CH3CH(OH)CH3
CH3CH2COONH4+2Ag↓+3NH3+H2O 取代反应 CH3CH2COOH+ CH3CH(OH)CH3![]() CH3CH2COOCH(CH3)2+H2O
CH3CH2COOCH(CH3)2+H2O 
【解析】
由转化关系可以知道,E含有羧基、G含有-OH,且E、G含有相同的碳原子数目,故E与G发生酯化反应生成H,由H的分子式可以知道,E为CH3CH2COOH,F中含有2个甲基,则G为CH3CH(OH)CH3,逆推可得,F为CH3CHClCH3,D为CH3CH2CHO,C为CH3CH2CH2OH,B为CH3CH2CH2Br,A为CH3CH=CH2,据此解答。
(1)通过以上分析知,D结构简式为CH3CH2CHO,故答案为:CH3CH2CHO;
(2)丙醛与银氨溶液反应的方程式为:CH3CH2CHO+2Ag(NH3)2OH![]() CH3CH2COONH4+2Ag↓+3NH3+H2O,故答案为:CH3CH2CHO+2Ag(NH3)2OH
CH3CH2COONH4+2Ag↓+3NH3+H2O,故答案为:CH3CH2CHO+2Ag(NH3)2OH![]() CH3CH2COONH4+2Ag↓+3NH3+H2O;
CH3CH2COONH4+2Ag↓+3NH3+H2O;
(3) A→B为丙烯和氯化氢反应生成氯丙烷,F→G为2-氯丙烷与氢氧化钠水溶液反应生成2-丙醇,二者均为取代反应,故答案为:取代反应;
(4) CH3CH2COOH和CH3CH(OH)CH3发生酯化反应生成H,反应的化学方程式为CH3CH2COOH+ CH3CH(OH)CH3![]() CH3CH2COOCH(CH3)2+H2O,故答案为:CH3CH2COOH+ CH3CH(OH)CH3
CH3CH2COOCH(CH3)2+H2O,故答案为:CH3CH2COOH+ CH3CH(OH)CH3![]() CH3CH2COOCH(CH3)2+H2O;
CH3CH2COOCH(CH3)2+H2O;
(5) H为CH3CH2COOCH(CH3)2,H有多种同分异构体,其中含有一个羧基,且其烃基上的一氯代物有两种的是 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2·2CO·2H2O
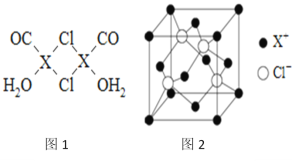
(1)X基态原子的电子排布式为__________________.
(2)C、H、O三种原子的电负性由大到小的顺序为__________.
(3)X2Cl2·2CO·2H2O是一种配合物,其结构如图1所示:
①与CO为互为等电子体的分子是_________.
②该配合物中氯原子的杂化方式为__________.
③在X2Cl22CO2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键_____________.
(4)阿伏加德罗常数的测定有多种方法,X射线衍射法就是其中的一种。通过对XCl晶体的X射线衍射图象的分析,可以得出XCl的晶胞如图2所示,则距离每个X+最近的Cl﹣的个数为____________,若X原子的半径为a pm,晶体的密度为ρg/cm3,试通过计算阿伏加德罗常数NA=___________________(列计算式表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素含量居金属首位,主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ.工业上用铝土矿制备铝的某种化合物的工艺流程如图:

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:___Fe2++___ClO-+___=___Fe(OH)3↓+___C1-+___
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为___(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、___(填操作名称)、过滤、洗涤。
Ⅱ.铵明矾(NH4Al(SO4)212H2O)是常见的食品添加剂,在日常生活、生产中也占有一席之地。
(1)铵明矾可用于净水,用离子方程式表示其净水原理___;向其溶液中逐滴加入NaOH溶液至过量,可观察到的现象是___。
(2)实验证明铵明矾高温分解后气体的组成成份是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=___。
(3)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为___(填代号)。
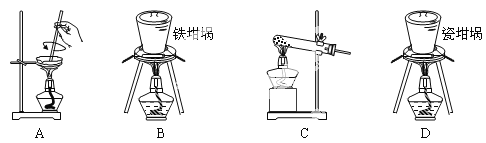
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。请回答:

(1)该密闭容器的容积是___。
(2)达到未平衡状态的时刻是___min(填“3”或“10”)。
(3)在前3min内,用H2浓度的变化表示的反应速率v(H2)=___mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为__。
(5)达平衡后H2O(g)的物质的量分数是___。
(6)已知:①CO(g)+2H2(g)=CH3OH(g) △H=-90.1kJ/mol,②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.1kJ/mol,则CO2与H2反应合成CH3OH(g)的热化学方程式__,反应在10min内所放出的热量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中两种气体的分子数一定相等的是( )
A.温度相同、体积相同的O2和N2
B.质量相等、密度不等的N2和C2H4
C.体积相同、密度不相等的CO和C2H4
D.压强相同、体积相同的O2和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“1.0 mol·L-1 NaCl溶液”的说法正确的是
A.该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B.若取该溶液50 mL,其中c(Cl-) = 0.05 mol·L-1
C.若取该溶液10 mL,恰好能与100 mL 0.1 mol·L-1 AgNO3溶液完全反应
D.该溶液与1.0 mol·L-1 Na2SO4溶液的c(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂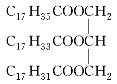 能发生的反应有( )
能发生的反应有( )
①皂化反应 ②使高锰酸钾酸性溶液褪色 ③使溴水褪色 ④氧化反应 ⑤还原反应 ⑥加成反应
A.①⑤B.①②③④
C.①④⑤⑥D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下化学反应CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为:K=________________。
(2)写出一种加快该化学反应的反应速率的方法_____________________。
(3)该反应为_____________反应(填“吸热”或“放热”)。
(4)下列能说明该反应已达到化学平衡状态的是____________________。
a.容器中压强不变 b.混合气体中c(CO)不变
c.υ正(H2)=2υ逆(H2O) d .c(CO2)=c(CO)
(5)某温度下,各物质的平衡浓度符合:c(CO2)c(H2)=c(CO)c(H2O),则该反应的反应温度为_______________________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在![]() 时,
时,![]()
![]()
![]()
![]()
![]() 、
、![]() 、
、![]()
又已知:![]() ,下列说法正确的是
,下列说法正确的是![]()
A.醋酸钠水解的平衡常数![]() 随温度升高而减小
随温度升高而减小
B.![]() 醋酸钠溶液pH为m,其水解的程度
醋酸钠溶液pH为m,其水解的程度![]() 已水解的醋酸钠与原有醋酸钠的比值
已水解的醋酸钠与原有醋酸钠的比值![]() 为a;
为a;![]() 醋酸钠溶液pH为n,水解的程度为b,则
醋酸钠溶液pH为n,水解的程度为b,则![]() 、
、![]()
C.醋酸钠的水解的平衡常数![]()
D.在某溶液中含![]() 、
、![]() 、
、![]() 三种离子的浓度均为
三种离子的浓度均为![]() ,向其中加入固体醋酸钠,使其浓度为
,向其中加入固体醋酸钠,使其浓度为![]() ,以上三种金属离子中只有
,以上三种金属离子中只有![]() 能生成沉淀
能生成沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com