
分析 (1)乙二酸为二元中强酸,酸性强于碳酸,存在电离平衡;
(2)由于题中强调足量的草酸,故反应后草酸转化为HC2O4-,若写成C2O42-是错误的.
(3)由紫红色褪去可知草酸具有还原性,把MnO4-还原为Mn2+,根据氧化还原反应得失电子守恒配平反应方程式;
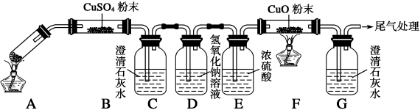
(4)由现象可知B中CuSO4固体检验草酸分解产物中的水,C装置检验草酸分解产物中的CO2,D装置的目的是为了除尽CO2,防止影响后续实验现象的判断,E装置用来干燥气体,F、G装置用来判断草酸分解产物中有无CO生成,乙二酸分解的化学方程式为H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO↑+CO2↑.
解答 解:(1)乙二酸为二元中强酸,酸性强于碳酸,存在电离平衡,则电离方程式为H2C2O4?HC2O4-+H+,故答案为:H2C2O4?HC2O4-+H+;
(2)题中强调足量的草酸,故反应后草酸转化为HC2O4-,且酸性强于碳酸,反应的离子方程式为HCO3-+H2C2O4=HC2O4-+CO2↑+H2O,
故答案为:HCO3-+H2C2O4=HC2O4-+CO2↑+H2O;
(3)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明具有氧化性的高锰酸钾被还原,说明草酸具有还原性,把MnO4-还原为Mn2+,反应中根据氧化剂得失电子守恒可知氧化剂和还原剂物质的量之间的关系为:2MnO4-~5H2C2O4,在根据电荷守恒和质量守恒可写出反应方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为:还原性;2;5;6;2;10;8;
(4)装置C、G中澄清石灰水变浑浊,B中粉末变蓝,F中粉末变红,可知B中CuSO4固体检验草酸分解产物中的水,B的作用为证明乙二酸分解产生了H2O,C装置检验草酸分解产物中的CO2,D装置的作用是除去混合气体中的CO2,防止影响后续实验现象的判断,E装置用来干燥气体,F、G装置用来判断草酸分解产物中有无CO生成,F中变红可知乙二酸分解有CO生成,则乙二酸分解的化学方程式为H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO↑+CO2↑,
故答案为:证明乙二酸分解产生了H2O;除去混合气体中的CO2;H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO↑+CO2↑.
点评 本题考查较综合,涉及性质实验方案的设计、离子反应、氧化还原反应等,注重高频考点的考查,把握(4)中实验装置的作用、实验现象与反应为解答的关键,侧重分析与实验能力的综合考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +3 | C. | +4 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水反应的实质:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 在加入铝粉能放出氢气的溶液中,K+、NO3-、CO32-、Cl-一定能够大量共存 | |
| C. | 铁和稀HNO3反应后,溶液pH=2:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 1 L0.1 mol•L-1FeCl3溶液和足量的Zn充分反应,生成11.2 g Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应混合物中各物质的浓度的改变 | B. | 反应物转化率的改变 | ||
| C. | 正逆反应速率的改变 | D. | 反应容器中压强的改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH4+含有的电子数为11NA | |
| B. | NH4+中N元素的化合价为-3,在氧化还原反应中常作氧化剂 | |
| C. | 0.1 L 3 mol•L-1的NH4NO3溶液中氮原子数等于0.6NA | |
| D. | 硫酸铵中既含有离子键,又含有共价键,而氯化铵中只含有离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com