
【题目】(12分)1000ml某待测溶液中除含有0.2mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(每次实验所加试剂均过量):

(1)写出生成白色沉淀B的离子方程式: 。
(2)待测液中肯定不存在的阳离子是 。
(3)若无色气体D是单一气体:判断原溶液中K+是否存在 (填是或否),若存在,求其物质的量浓度的最小值,若不存在,请说明理由: 。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是 。
②沉淀A中能与稀硝酸反应的成分是 (写化学式)。
【答案】(1)Ba2++HCO3-+OH-=BaCO3↓+H2O;(2)Fe3+,Ba2+;
(3)存在;0.1mol/L;(4)①CO32-、HCO3-、SO32-;②BaCO3、BaSO3。
【解析】
试题分析:待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32-、SO32-、SO42-,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32-,可能存在SO32-、SO42-中的两种或一种,根据离子共存存知,溶液中不存在Ba2+;滤液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、Ba2+ ,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br-,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl-,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl-。(1)由上述分析可知,白色沉淀B为碳酸钡,是由HCO3-、Ba2+、OH-反应生成,反应离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O;(2)由上述分析可知,溶液中一定没有的阳离子是:Fe3+、Ba2+;(3)由上述分析可知,溶液中一定含有CO32-、HCO3-,不能确定原溶液中是否含有Cl-,溶液中一定没有Br-,若无色气体D是混合气体,只能为CO2、NO混合气体,白色沉淀D只能为BaSO4,溶液中一定含有SO32-,不能确定是否含有SO42-,沉淀A中一定含有BaCO3,BaSO3。①待测液中一定含有的阴离子是CO32-、HCO3-、SO32-;②n(NH4+)=n(NH3)= 2.24L÷22.4L/mol=0.1mol,则c(NH4+)=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO3-)=0.1mol/L,c(CO32-)=0.1mol/L,c(SO42-)=0.05mol/L,单位体积为正电荷=1×0.1mol/L+1×0.2mol/L=0.3mol/L,单位体积内负电荷=1×0.1mol/L+ 2×0.1mol/L+ 2×0.05mol/L =0.4mol/L,单位体积为正电荷<单位体积内负电荷,故一定含有K+,当溶液中没有Cl-,K+离子浓度最小,根据电荷守恒可知,c(K+)最小浓度=0.4mol/L- 0.3mol.L=0.1mol/L;(4)由上述分析可知,溶液中一定含有CO32-、HCO3-,不能确定原溶液中是否含有Cl-,溶液中一定没有Br-。若无色气体D是混合气体,只能为CO2、NO混合气体,白色沉淀D只能为BaSO4,溶液中一定含有SO32-,不能确定是否含有SO42-,沉淀A中一定含有BaCO3,BaSO3。①待测液中一定含有的阴离子是CO32-、HCO3-、SO32-;②沉淀A中BaCO3、BaSO3;BaSO3能与稀硝酸反应转化为硫酸钡,故沉淀A为:BaCO3、BaSO3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列反应能用化合直接制得的是
①FeCl2 ②FeCl3 ③Fe(OH)2 ④Fe(OH)3 ⑤Cu2S
A.①②④⑤ B.②③④ C.②④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
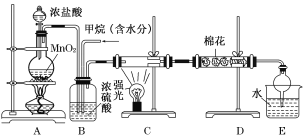
试回答下列问题:
(1)请写出C装置中生成CH3Cl的化学反应方程式:______________________________。
有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法________(填“正确”或 “不正确”)。
(2)B装置有三种功能;①控制气流速度;②混匀混合气体;③________。
(3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有________溶液。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。
A.分液法 B.蒸馏法 C.结晶法
(5)将1molCH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为 ,生成HCl的物质的量共为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的气态氢化物能使湿润的红色石蕊试纸变蓝;F的最高价氧化物对应水化物既能和酸反应又能和强碱反应,G单质是日常生活中用量最大的金属,易被腐蚀。请回答下列问题:
(1)A元素在周期表中的位置是 。
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:(任写一种) ;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH 7(填 “>"或“<”或“=”)。
(4)写出F的单质与NaOH溶液反应的离子方程式:____________________。
(5)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式 。
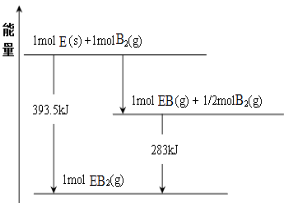

(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为 。某同学假设正极产物是Fe2+,请你设计实验证明该假设 。
(7)A与D形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配置480mL 0.1molL-1CuSO4溶液为例,所需容量瓶的规格__________,需称量胆矾的
质量是__________g,配置成功后从容量瓶中取出10mL于试管中,则试管中溶液的浓度是__________molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C都是金属:B中混有C时,只有C能被盐酸溶解;A与B组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为( )。
A. A>B>C B. A>C>B
C. C>B>A D. B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法正确的是:( )
A.工业用 Cl2 与澄清石灰水反应制取漂白粉
B.天然纤维与合成纤维的主要成分都是纤维素
C.福尔马林可用于保存海鲜制品
D.Na 可用于冶炼金属钛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有下列电子排布式的原子中,半径最大的是
A. ls22s22p63s23p3
B. 1s22s22p3
C. 1s22s22p4
D. 1s22s22p63s23p4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com