
(14分)3-丁酮酸乙酯在有机合成中用途极广,广泛用于药物合成,还用作食品的着香剂。其相对分子质量为130,常温下为无色液体,沸点181℃,受热温度超过95℃摄氏度时就会分解;易溶于水,与乙醇、乙酸乙酯等有机试剂以任意比混溶;实验室可用以乙酸乙酯和金属钠为原料制备。乙酸乙酯相对分子质量为88,常温下为无色易挥发液体,微溶于水,沸点77℃。
【反应原理】

【实验装置】

【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是 。
(2)反应装置中加干燥管是为了 。两个装置中冷凝管的作用 (填“相同”或“不相同”),冷却水进水口分别为 和 (填图中的字母)。
(3)产物后处理中,滴加稀醋酸的目的是 ,稀醋酸不能加多了,原因是 。用分液漏斗分离出酯层的操作叫 。碳酸钠溶液洗涤的目的是 。加碳酸钾的目的是 。
(4)采用减压蒸馏的原因是 。
(5)本实验所得到的3-丁酮酸乙酯产率是 (填正确答案标号)。
A.10% B.22% C.19% D.40%
(1)催化剂(2分) (2)防湿气进入反应体系中以保证反应体系干燥(1分);
不相同(1分);b(1分);d(1分)。 (3)中和生成的钠盐,使之变成产物(1分);酸多了会增加产物在水中的溶解度(1分);分液(1分);中和醋酸(1分);干燥(1分)。
(4)3-丁酮酸乙酯沸点高,在沸点温度下还易分解(1分)。 (5)B(2分)
【解析】
试题分析:(1)根据方程式可知加入无水乙醇后又产生乙醇,这说明乙醇在反应中起到催化剂的作用。
(2)空气中含有水蒸气,因此装置中加干燥管是为了防湿气进入反应体系中以保证反应体系干燥;反应装置中冷凝管的作用是冷凝回流,挺高原料的利用率。减压装置中冷凝管的作用是冷却蒸发出的蒸汽便于得到产品。为充分冷凝,使冷水充满冷凝器,因此冷却水的流向分别是b和d。
(3)由于产物中含有钠盐,因此产物处理后,滴加稀醋酸的目的是中和生成的钠盐,使之变成产物;由于酸多了会增加产物在水中的溶解度,所以醋酸不能滴加的过多。用分液漏斗分离出酯层的操作叫分液。酯类在碳酸钠溶液中的溶解度小,所以为出去酯中的醋酸,需要滴加碳酸钠溶液。碳酸钾吸水,因此加碳酸钾的目的是干燥产品。
(4)3-丁酮酸乙酯沸点高,而受热温度超过95℃摄氏度时就会分解,所以需要减压蒸馏。
(5)根据反应物的用量可知钠不足,因此理论上生成产品的物质的量是0.07mol,其质量是0.07mol×130g/mol=9.1g,所以产率是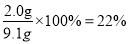 ,答案选B。
,答案选B。
考点:考查有机物制备的实验方案设与探究


科目:高中化学 来源:2014-2015学年浙江省宁波市高三一月化学试卷(解析版) 题型:推断题
(9分)甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系。
甲 + H2O → 丙 + 丁
(1)转化关系中所涉及的反应为非氧化还原反应。
①若甲是一种钠盐,丁为两性氢氧化物,则甲的化学式为 ,丁的酸式电离方程式为 。
②若甲是由N和Cl元素组成的化合物,其分子结构模型如图所示,丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的电子式为

(2)转化关系中所涉及的反应为氧化还原反应。
①若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,此反应的离子方程式是 。
②若丙和丁都可在一定条件下还原CuO,此反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的数值,下列说法正确的是
A.1mol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA
B.标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA
C.8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
D.1 mol Na被完全氧化生成Na2O2,失去2 NA个电子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
某溶液中含有AlO2-、SO32-、SO42-、Na+,向其中加入Na2O2后,溶液中浓度基本保持不变的离子是
A.SO32- B.Na+ C.AlO2- D.SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省襄阳市高三1月调研理综化学试卷(解析版) 题型:填空题
[化学─选修5:有机化学基础](15分)
(一)2014年国际禁毒日的主题是“珍惜美好青春,远离合成毒品、拒绝毒品、健康人生”。下图是大麻的主要成分THC的结构式。

(1)该物质含有的官能团的名称为 ,它的分子式为 ,分子中手性碳原子数为 。
(2)下列关于THC的说法中正确的是
A.分子中含有苯环,属于芳香烃类化合物
B.难溶于水,易溶于乙醇、乙醚、苯和碱溶液
C.可以发生加成反应、取代反应、氧化反应、消去反应
D.除氢原子外,分子中所有的其它原子都在一个平面上
E.遇FeCl3溶液显紫色;可以使溴的四氯化碳溶液褪色
F.通常状态下,1mol该物质最多可与3mol Br2发生反应
(二)香豆素是重要的香料、医药中间体。某研究小组设计的合成香豆素路线如下:

提示:2CH3CHO+(CH3CO)2O 2CH3CH=CHCOOH+H2O
2CH3CH=CHCOOH+H2O
(1)A→B的化学方程式为 。
(2)D的核磁共振氢谱图中的吸收峰有 个。反应⑤的有机反应类型是 反应。H的结构简式为 。
(3)已知芳香族化合物I是G的同分异构体,且I的苯环上只有一个取代基。则I的结构简式可能为
。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省襄阳市高三1月调研理综化学试卷(解析版) 题型:选择题
下图是金属镁和卤素反应的能量变化图(反应物和产物均为298 K时的稳定状态)。下列选项中不正确的是

A.Mg与F2反应的△S<0
B.MgF2(s)+Br2(l)==MgBr2(s)+F2(g)△H=+600kJ·mol-1
C.MgBr2与Cl2反应的△H<0
D.化合物的热稳定顺序:MgI2>MgBr2>MgCl2>MgF2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省武汉市武昌区高三元月调考理综化学试卷(解析版) 题型:实验题
(15分)三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体。实验室合成三苯甲醇的实验装置如图所示。

已知:①过程中生成的中间物质格氏试剂易发生水解反应;
②部分相关物质的沸点如下:
物质 | 沸点/℃ |
三苯甲醇 | 380 |
乙醚 | 34.6 |
溴苯 | 156.2 |
③三苯甲醇的相对分子质量为260。
请回答下列问题:
(1)装置中玻璃仪器B的名称为 ;装有无水CaCl2的仪器A的作用是 。
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是 ;制取格氏试剂时要保持温度约为40℃,可以采用 加热方式。
(3)制得的三苯甲醇粗产品中含有乙醚、溴苯、氯化铵等杂质,可以设计如下提纯方案:

其中,操作①的名称是 ;洗涤液最好选用 (填字母序号)。
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为 。
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80 mL。则产品中三苯甲醇的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:选择题
已知:锂离子电池的总反应为:LixC+Li1-xCoO2 C+LiCoO2,锂硫电池的总反应为: 2Li+S
C+LiCoO2,锂硫电池的总反应为: 2Li+S Li2S。有关上述两种电池说法正确的是
Li2S。有关上述两种电池说法正确的是

A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.上图表示用锂离子电池给锂硫电池充电
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市高一上学期期中考试化学试卷(解析版) 题型:选择题
设NA为阿佛加德罗常数,下列对于0.3mol/L的硫酸钾溶液的说法中不正确的是
A.1L溶液中含有0.6NA个钾离子
B.1L溶液中含有钾离子和硫酸根离子总数为0.9NA
C.2L溶液中钾离子浓度为1.2mol/L
D.2L溶液中含有硫酸根离子0.6NA个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com