
”¾ĢāÄæ”æĒāĘųŹĒŅ»ÖÖĒå½ąÄÜŌ“£®ÖĘĒāŗĶ“¢Ēā×÷ĪŖĒāÄÜĄūÓĆµÄ¹Ų¼ü¼¼Źõ£¬ŹĒµ±Ē°æĘѧ¼ŅÖ÷ŅŖ¹Ų×¢µÄČȵćĪŹĢā£®
£Ø1£©ÓĆ¼×ĶéÖĘČ”ĒāĘųµÄĮ½²½·“Ó¦µÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£ŗ 
¢Ł¼×ĶéŗĶĖ®ÕōĘų·“Ӧɜ³É¶žŃõ»ÆĢ¼ŗĶĒāĘųµÄČČ»Æѧ·½³ĢŹ½ŹĒ £®
¢ŚµŚ¢ņ²½·“Ó¦ĪŖæÉÄę·“Ó¦£®800”ꏱ£¬ČōCOµÄĘšŹ¼ÅضČĪŖ2.0molL©1 £¬ Ė®ÕōĘųµÄĘšŹ¼ÅضČĪŖ3.0molL©1 £¬ “ļµ½»ÆŃ§Ę½ŗāדĢ¬ŗ󣬲āµĆCO2µÄÅضČĪŖ1.2molL©1 £¬ ŌņCOµÄĘ½ŗā×Ŗ»ÆĀŹĪŖ £®
£Ø2£©NaBH4ŹĒŅ»ÖÖÖŲŅŖµÄ“¢ĒāŌŲĢ壬ÄÜÓėĖ®·“Ӧɜ³ÉNaBO2 £¬ ĒŅ·“Ó¦Ē°ŗóBŌŖĖŲµÄ»ÆŗĻ¼Ū²»±ä£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £¬ ·“Ó¦ĻūŗÄ1mol NaBH4Ź±×ŖŅʵĵē×ÓŹżÄæĪŖ £®
£Ø3£©“¢Ēā»¹æɽčÖśÓŠ»śĪļ£¬ČēĄūÓĆ»·ŅŃĶéŗĶ±½Ö®¼äµÄæÉÄę·“Ó¦Ą“ŹµĻÖĶŃĒāŗĶ¼ÓĒā£® 
ŌŚÄ³ĪĀ¶ČĻĀ£¬ĻņŗćČŻČŻĘ÷ÖŠ¼ÓČė»·ŅŃĶ飬ĘäĘšŹ¼ÅضČĪŖa molL©1 £¬ Ę½ŗāŹ±±½µÄÅضČĪŖb molL©1 £¬ øĆ·“Ó¦µÄĘ½ŗā³£ŹżK=£ØÓĆŗ¬a”¢bµÄ¹ŲĻµŹ½±ķ“ļ£©£®
”¾“š°ø”æ
£Ø1£©CH4£Øg£©+2H2O£Øg£©=4H2£Øg£©+CO2£Øg£©”÷H=©136.5kJ/mol£»60%
£Ø2£©NaBH4+2H2O=NaBO2+4H2”ü£»4NA»ņ2.408”Į1024
£Ø3£©![]() mol3?L©3
mol3?L©3
”¾½āĪö”æ½ā£ŗ£Ø1£©¢Łøł¾ŻµŚŅ»²½·“Ó¦¹ż³ĢæÉŅŌµĆ³ö£ŗCH4£Øg£©+H2O£Øg£©=3H2£Øg£©+CO£Øg£©£¬”÷H=©103.3KJ/mol£»
øł¾ŻµŚ¶ž²½·“Ó¦¹ż³ĢæÉŅŌµĆ³ö£ŗCO£Øg£©+H2O£Øg£©=H2£Øg£©+CO2£Øg£©£¬”÷H=©33.2KJ/mol£»
øł¾ŻøĒĖ¹¶ØĀÉ£¬ÉĻĻĀĮ½Ź½Ļą¼ÓæÉµĆ£ŗCH4£Øg£©+2H2O£Øg£©=4H2£Øg£©+CO2£Øg£©”÷H=©136.5 kJ/mol£¬
ĖłŅŌ“š°øŹĒ£ŗCH4£Øg£©+2H2O£Øg£©=4H2£Øg£©+CO2£Øg£©”÷H=©136.5 kJ/mol£»
¢ŚÉčCOµÄĘ½ŗā×Ŗ»ÆĮæĪŖx£¬
CO£Øg£©+ | H2O£Øg£©= | H2£Øg£©+ | CO2£Øg£© | |
³õŹ¼ÅØ¶Č£ŗ | 2.0 | 3.0 | 0 | 0 |
±ä»ÆÅØ¶Č£ŗ | 1.2 | 1.2 | 1.2 | 1.2 |
Ę½ŗāÅØ¶Č£ŗ | 0.8 | 0.8 | 1.2 | 1.2 |
ŌņCOµÄĘ½ŗā×Ŗ»ÆĀŹĪŖ ![]() ”Į100%=60%£¬
”Į100%=60%£¬
ĖłŅŌ“š°øŹĒ£ŗ60%£»£Ø2£©NaBH4ÓėĖ®·“Ӧɜ³ÉNaBO2 £¬ ĒŅ·“Ó¦Ē°ŗóBµÄ»ÆŗĻ¼Ū²»±ä£¬NaBO2ÖŠBŌŖĖŲ»ÆŗĻ¼ŪĪŖ+3¼Ū£¬ĖłŅŌNaBH4ÖŠHŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ©1¼Ū£¬ĖłŅŌHŌŖĖŲ»ÆŗĻ¼ŪÓÉ©1¼Ū”¢+1¼Ū±äĪŖ0¼Ū£¬ŌŁ½įŗĻ×ŖŅʵē×ÓŹŲŗćÅäĘ½·½³ĢŹ½ĪŖNaBH4+2H2O=NaBO2+4H2”ü£¬·“Ó¦ĻūŗÄ1mol NaBH4Ź±×ŖŅʵÄĪļÖŹµÄĮæ=1mol”Į4”Į£Ø1©0£©=4mol£¬ĖłŅŌ×ŖŅʵē×ÓŹżĪŖ4NA»ņ2.408”Į1024 £¬ ĖłŅŌ“š°øŹĒ£ŗNaBH4+2H2O=NaBO2+4H2”ü£»4NA»ņ2.408”Į1024£»£Ø3£©»·¼ŗĶéµÄĘšŹ¼ÅضČĪŖamolL©1 £¬ Ę½ŗāŹ±±½µÄÅضČĪŖbmolL©1 £¬ Ķ¬Ņ»ČŻĘ÷ÖŠø÷ĪļÖŹ·“Ó¦µÄĪļÖŹµÄĮæÅضČÖ®±ČµČÓŚĘä¼ĘĮæŹżÖ®±Č£¬ĖłŅŌøł¾Ż·½³ĢŹ½ÖŖ£¬»·¼ŗĶéµÄĘ½ŗāÅضČĪŖ£Øa©b£©mol/L£¬ĒāĘųµÄÅضČĪŖ3bmol/L£¬ŌņĘ½ŗā³£ŹżK= ![]() mol3L©3=
mol3L©3= ![]() =
= ![]() mol3L©3 £¬
mol3L©3 £¬
ĖłŅŌ“š°øŹĒ£ŗ ![]() mol3L©3 £®
mol3L©3 £®
”¾æ¼µć¾«Īö”æĄūÓĆ»ÆŃ§Ę½ŗāµÄ¼ĘĖć¶ŌĢāÄæ½ųŠŠÅŠ¶Ļ¼“æɵƵ½“š°ø£¬ŠčŅŖŹģÖŖ·“Ó¦Īļ×Ŗ»ÆĀŹ=×Ŗ»ÆÅØ¶Č”ĀĘšŹ¼ÅØ¶Č”Į100%=×Ŗ»ÆĪļÖŹµÄĮæ”ĀĘšŹ¼ĪļÖŹµÄĮæ”Į100%£»²śĘ·µÄ²śĀŹ=Źµ¼ŹÉś³É²śĪļµÄĪļÖŹµÄĮæ”ĀĄķĀŪÉĻæɵƵ½²śĪļµÄĪļÖŹµÄĮæ”Į100%£®


 ŗ®¼Ł““ŠĀŠĶ×ŌÖ÷ѧĻ°µŚČżŃ§ĘŚŗ®¼ŁĻĪ½ÓĻµĮŠ“š°ø
ŗ®¼Ł““ŠĀŠĶ×ŌÖ÷ѧĻ°µŚČżŃ§ĘŚŗ®¼ŁĻĪ½ÓĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ”°īÜĢŖŻ¼”±·Ö×Ó£ØÖ±¾¶Ō¼ĪŖ1.34x10£9m£©½į¹¹ŗĶŠŌÖŹÓėČĖĢåÄŚµÄŃŖŗģĖŲ¼°Ö²ĪļÄŚµÄŅ¶ĀĢĖŲ·Ē³£ĻąĖĘ”£ĻĀĮŠ¹ŲÓŚ”°īÜĢŖŻ¼”±·Ö×ÓµÄĖµ·ØÖŠÕżČ·µÄŹĒ
A. ”°īÜĢŖŻ¼”±·Ö×ÓŌŚĖ®ÖŠĖłŠĪ³ÉµÄ·ÖÉ¢ĻµŹōŠü×ĒŅŗ
B. ”°īÜĢŖŻ¼”±·Ö×Ó¼ČÄÜĶø¹żĀĖÖ½£¬Ņ²ÄÜĶø¹ż°ėĶøĤ
C. ŌŚ·ÖÉ¢ĻµÖŠ£¬”°īÜĢŖŻ¼”±·Ö×ÓÖ±¾¶±ČNa+µÄÖ±¾¶Š”
D. ”°īÜĢŖŻ¼”±·Ö×ÓŌŚĖ®ÖŠŠĪ³ÉµÄ·ÖÉ¢ĻµÄܲśÉś¶”“ļ¶ūĻÖĻó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚøßĪĀøßŃ¹ĻĀCO¾ßÓŠ¼«øߵĻÆѧ»īŠŌ£¬ÄÜÓė¶ąÖÖµ„ÖŹ»ņ»ÆŗĻĪļ·“Ó¦£®
£Ø1£©ČōŌŚŗćĪĀŗćČŻµÄČŻĘ÷ÄŚ½ųŠŠ·“Ó¦C£Øs£©+H2O£Øg£©CO£Øg£©+H2£Øg£©£¬ŌņæÉÓĆĄ“ÅŠ¶ĻøĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ÓŠ £® £ØĢī×ÖÄø£©
a£®ČŻĘ÷ÄŚµÄŃ¹Ēæ±£³Ö²»±ä
b£®ČŻĘ÷ÖŠH2ÅضČÓėCOÅضČĻąµČ
c£®ČŻĘ÷ÖŠ»ģŗĻĘųĢåµÄĆܶȱ£³Ö²»±ä
d£®COµÄÉś³ÉĖŁĀŹÓėH2µÄÉś³ÉĖŁĀŹĻąµČ
£Ø2£©COŅ»æÕĘųČ¼ĮĻµē³ŲÖŠŹ¹ÓƵĵē½āÖŹŹĒ²óŌÓĮĖY2O3µÄZrO2¾§Ģ壬ĖüŌŚøßĪĀĻĀÄÜ“«µ¼O2 £® øƵē³Ųøŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ £®
£Ø3£©Ņ»¶ØĢõ¼žĻĀ£¬COÓėH2æÉŗĻ³É¼×Ķ飬·“Ó¦·½³ĢŹ½ĪŖ£ŗCO£Øg£©+3H2£Øg£©CH4£Øg£©+H2O£Øg£©
¢ŁŅ»¶ØĢõ¼žĻĀ£¬øĆ·“Ó¦Äܹ»×Ō·¢½ųŠŠµÄŌŅņŹĒ £®
¢ŚŅŃÖŖH2£Øg£©”¢CO£Øg£©ŗĶ CH4£Øg£©µÄČ¼ÉÕČČ·Ö±šĪŖ285.8kJmol©1”¢283.0kJmol©1ŗĶ890£¬0kJmol©1 £®
Š“³öCOÓėH2·“Ӧɜ³ÉCH4ŗĶCO2µÄČČ»Æѧ·½³ĢŹ½£ŗ
£Ø4£©¹¤ŅµÉĻæÉĶعż¼×“¼ōŹ»ł»Æ·ØÖĘČ”¼×Ėį¼×õ„£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗCH3OH£Øg£©+CO£Øg£© ![]() HCOOCH3£Øg£©”÷H=©29.1kJmol©1 £® æĘŃŠČĖŌ±¶ŌøĆ·“Ó¦½ųŠŠĮĖŃŠ¾æ£®²æ·ÖŃŠ¾æ½į¹ūČēĶ¼ĖłŹ¾£ŗ
HCOOCH3£Øg£©”÷H=©29.1kJmol©1 £® æĘŃŠČĖŌ±¶ŌøĆ·“Ó¦½ųŠŠĮĖŃŠ¾æ£®²æ·ÖŃŠ¾æ½į¹ūČēĶ¼ĖłŹ¾£ŗ 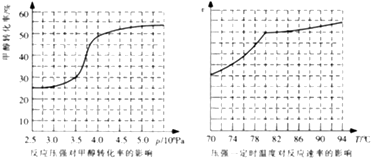
¢Ł“Ó·“Ó¦Ń¹Ēæ¶Ō¼×“¼×Ŗ»ÆĀŹµÄÓ°Ļģ”°Š§ĀŹ”°æ“£¬¹¤ŅµÖĘČ”¼×Ėį¼×õ„ӦєŌńµÄŃ¹ĒæŹĒ £®
¢ŚŹµ¼Ź¹¤ŅµÉś²śÖŠ²ÉÓƵÄĪĀ¶ČŹĒ80”ę£¬ĘäĄķÓÉŹĒ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĢśÖłŠč³¤ĘŚ½žČėĖ®ĻĀ£¬ĪŖĮĖ¼õÉŁøÆŹ“£¬ĻĀĮŠ“ėŹ©ÖŠ²»ÄÜ“ļµ½ÄæµÄŹĒ
A.ŌŚĢśÖłÉĻĆÉĻŅ»Š©ŠæʬB.½«ĢśÖłÓėÖ±Į÷µēŌ“µÄÕż¼«ĻąĮ¬
C.ŌŚĢśÖł±ķĆęĶæÉĻŅ»²ć½ĻŗńµÄĮ¤ĒąD.ŌŚĢśÖł±ķĆę¶ĘĪż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪĀ¶ČŹ±£¬ŌŚŅ»øöČŻ»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ£¬X”¢Y”¢ZČżÖÖĘųĢåµÄĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£øł¾ŻĶ¼ÖŠŹż¾Ż£¬ĻĀĮŠÓŠ¹ŲĖµ·Ø“ķĪóµÄŹĒ
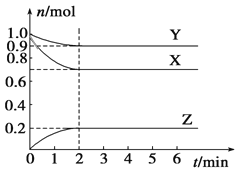
A. øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ3X£«Y![]() 2Z
2Z
B. 2 minŹ±£¬·“Ó¦“ļ×ī“óĻŽ¶Č£¬µ«»Æѧ·“Ó¦ČŌŌŚ½ųŠŠ
C. 2 minÄ©Ź±£¬ZµÄ·“Ó¦ĖŁĀŹĪŖ0.05 mol”¤L-1”¤min-1
D. ·“Ó¦“ļµ½Ę½ŗāŹ±£¬Ń¹ĒæŹĒæŖŹ¼Ź±µÄ0.9±¶
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚ“æ¾»Īļ”¢»ģŗĻĪļ”¢Ēæµē½āÖŹ”¢Čõµē½āÖŹµÄÕżČ·×éŗĻŹĒ
“æ¾»Īļ | »ģŗĻĪļ | Ēæµē½āÖŹ | Čõµē½āÖŹ | ·Ēµē½āÖŹ | |
A | “æŃĪĖį | Ė®ĆŗĘų | ĮņĖį | “×Ėį | øɱł |
B | ±ł“×Ėį | ø£¶ūĀķĮÖ | ĮņĖį±µ | ŃĒĮņĖį | ČżŃõ»ÆĮņ |
C | ÓĶõ„ | µķ·Ū | æĮŠŌ¼Ų | ĒāĮņĖį | Ģ¼ĖįøĘ |
D | ÖŲĖ® | ĻĖĪ¬ĖŲ | ĀČ»ÆÄĘ | “ĪĀČĖį | ĀČĘų |
A.AB.BC.CD.D
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚĪŽÉ«ĶøĆ÷µÄĒæĖįŠŌČÜŅŗÖŠ£¬ÄÜ“óĮæ¹²“ęµÄĄė×Ó×éŹĒ
A. NH4+”¢Mg2+”¢SO42£”¢NO3£ B. Ba2+”¢Na+”¢OH£”¢Cl£
C. K+”¢NH4+”¢MnO4£”¢SO42£ D. K +”¢Na+”¢NO3£”¢HCO3£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŠšŹöÕżČ·µÄŹĒ
A. 1 mol H2OµÄÖŹĮæĪŖ18g/mol
B. CH4µÄĦ¶ūÖŹĮæĪŖ16g
C. 3.01”Į1023øöSO2·Ö×ÓÖŹĮæĪŖ32g
D. ±ź×¼×“æöĻĀ£¬0.5 molČĪŗĪĪļÖŹµÄĢå»ż¾łŌ¼ĪŖ11.2L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµČĪļÖŹµÄĮæµÄ SO2ŗĶSO3ĻĀĮŠ¹ŲĻµ“ķĪóµÄŹĒ£Ø £©
A. Ėłŗ¬ĮņŌ×ÓµÄĪļÖŹµÄĮæÖ®±ČĪŖ1:1
B. ŃõŌ×ÓµÄĪļÖŹµÄĮæÖ®±ČĪŖ2:3
C. ŃõŌŖĖŲµÄÖŹĮæ±ČĪŖ3:2
D. ĮņŌŖĖŲµÄÖŹĮæ±ČĪŖ1:1
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com