
|
在某温度下,反应 ClF(g)+F2(g) | |
| [ ] | |
A. |
温度不变,缩小体积, ClF的转化率增大 |
B. |
温度不变,增大体积, ClF3的产率提高 |
C. |
升高温度,增大体积,有利于平衡向正反应方向移动 |
D. |
降低温度,体积不变, F2的转化率降低 |
科目:高中化学 来源: 题型:
| 物 质 | 甲 | 乙 | 丙 |
| 浓度/mol?L-1 | 0.01 | 0.2 | 0.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
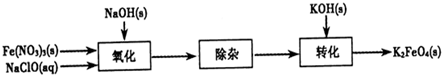
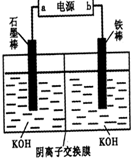
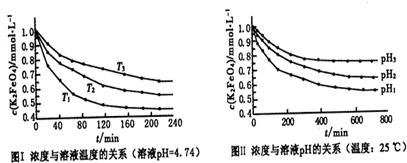
查看答案和解析>>
科目:高中化学 来源:黄冈重点作业 高三化学(下) 题型:022
在某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KCIO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量之比为1∶2,则Cl2与KOH反应时,被还原的Cl和被氧化的Cl的物质的量之比为________,其化学反应方程式为_______________________________________
查看答案和解析>>
科目:高中化学 来源:黄冈重点作业 高三化学(下) 题型:022
在某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KCIO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量之比为1∶2,则Cl2与KOH反应时,被还原的Cl和被氧化的Cl的物质的量之比为________,其化学反应方程式为_______________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com