
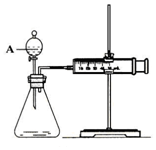
 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表| 时间/s | 0 | t | 2t | … |
| 活塞的位置/ml | 17.3 | 25.6 | 36.6 | … |
| 实验序号 | 双氧水体积/mL | 蒸馏水体积/mL | 添加的物质 |
| 1 | 10 | 0 | 4mLFeCl3 |
| 2 | 10 | 2 | 2mLCuCl2 |
 .
. | 0.1g | 0.3g | 0.8g |
| 10mL1.5% | 223s | 67s | 36s |
| 10mL3.0% | 308s | 109s | 98s |
| 10mL4.5% | 395s | 149s | 116s |
分析 (1)装置气密性检验的原理是:通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;(2)根据实验室常见仪器特征及名称判断;
(3)活塞的位置为生成气体的体积,根据相同时间生成气体的体积判断反应速率快慢;反应温度越高,反应速率越快;
(4)①双氧水在氯化铁作催化剂分解生成水和氧气,据此写出H2O2分解反应方程式并根据化合价变化标明电子转移的方向和数目;
②在相同的条件下利用一个变量来比较,现催化剂不同,需反应的体积相同;
③通过相同时间生成气体的体积大小或生成相同体积的气体所需时间大小判断;
(5)①根据表中双氧水的量相同条件下,加入二氧化锰的质量多少对反应速率的快慢进行判断;
②结合表中数据分析,双氧水的浓度相同时,加入的最佳的二氧化锰的量;
③根据表中数据分析相同体积时3.0%的双氧水中与1.5%的双氧水,得出双氧水的浓度与反应速率的关系.
解答 解:(1)通过气体发生器与液体构成封闭体系,依据改变体系内压强时产生的现象判断装置气密性,所以检验该套装置的气密性的方法为:将装置安装好后,关闭分液漏斗活塞,将注射器活塞拉出一定距离,然后松开活塞,若活塞回到原位则气密性良好;或先将活塞位置固定好,然后从分液漏斗中加水,若水不能顺利流下,则装置气密性好,
故答案为:将装置安装好后,关闭分液漏斗活塞,将注射器活塞拉出一定距离,然后松开活塞,若活塞回到原位则气密性良好;或先将活塞位置固定好,然后从分液漏斗中加水,若水不能顺利流下,则装置气密性好;
(2)根据实验室常见仪器名称判断,盛装双氧水的化学仪器A具有活塞装置的漏斗,名称是分液漏斗,
故答案为:分液漏斗;
(3)0-ts,生成气体25.6-17.3=8.3mL,t-2t,生成气体36.6-25.6=11mL,相同时间生成气体的体积t-2t 多,所以t-2t 快,是因为镁与硫酸反应放热,温度升高,反应速率加快,
故答案为:t-2t;镁与硫酸反应放热,温度升高,反应速率加快;
(4)①双氧水分解的方程式为:2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑,反应中双氧水既是氧化剂也是还原剂,双氧水中氧元素化合价为-1价,变成氧气失去2个电子,生成水得到2个电子,用双线桥标明电子转移的方向和数目为: ,
,
故答案为: ;
;
②,则该实验的目的为探究催化剂对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,实验1和2需体积相同,所以需4mLFeCl3,
故答案为:4;
③探究Fe3+、Cu2+对双氧水分解速率的影响,通过过氧化氢分解生成的氧气的量判断,可收集相同体积的氧气所需时间(或相同时间产生氧气的体积)测定,
故答案为:收集相同体积的氧气所需时间(或相同时间产生氧气的体积);
(5)①由表中数据可知,双氧水的量相同,加入的二氧化锰质量越多,反应所需的时间越短,说明反应速率越快,
故答案为:加快;
②根据表中数据,在双氧水的浓度相同时,加入0.3g二氧化锰与加入0.1g二氧化锰对化学反应速率影响相差较大,加入0.3g二氧化锰与加入0.5g二氧化锰对反应速率的影响相差不是很大,所以加入二氧化锰的最佳量为0.3g,
故答案为:0.3;
③从表中数据可知,相同体积3.0%的双氧水中的溶质含量是1.5%的双氧水中溶质含量的二倍,但反应的时间却比其反应时间的二倍小得多,由反应速率计算公式(v=$\frac{△c}{△t}$)可得出,此实验条件下双氧水的浓度越大分解速率越快,
故答案为:不正确;H2O2的浓度扩大二倍(从1.5%-→3.0%),但反应所需时间比其二倍小的多.
点评 本题考查了探究影响化学反应速率的因素,题目难度中等,试题侧重考查学生的分析、理解能力及对所学知识的灵活应用能力,明确实验目的为解答关键,注意掌握温度、浓度、催化剂等因素对反应速率的影响.


科目:高中化学 来源: 题型:选择题
| A. | 46gNO2和N2O4的混合气体中含有的原子个数为3NA | |
| B. | 标准状况下,22.4L乙醇完全燃烧后生成的CO2分子数为2NA | |
| C. | 1mol苯中所含的碳碳双键数为3NA | |
| D. | 1mol Cl2与过量Fe反应,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
| 1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
| 2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
| 3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
| 4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
| 5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10Be和9Be是中子数不同质子数相同的不同原子 | |
| B. | 10Be的原子核内中子数比质子数少 | |
| C. | 5.2 g 26Al3+中所含的电子数约为1.2×1024 | |
| D. | 26Al和26Mg的质子数、中子数和核外电子数都不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | L层上的电子数为奇数的原子不一定是主族元素的原子 | |
| B. | 只由共价键形成的物质不一定是共价化合物 | |
| C. | 化学键的形成一定伴随着电子的转移和能量变化 | |
| D. | 元素周期表中,位于金属和非金属分界线附近的元素属于过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
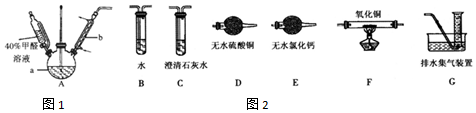
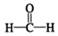 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$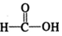 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$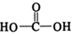 (H2CO3)设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价.
(H2CO3)设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价.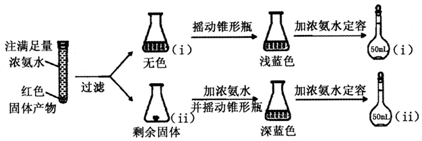
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
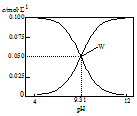
| A. | 将0.1 mol•L-1的HCN溶液和0.1 mol•L-1NaCN溶液等体积混合(忽略溶液体积变化):c(Na+)>c(HCN)>c(CN-)>c(OH-)>c(H+) | |
| B. | W点表示溶液中:c(Na+)+c(H+)=c(HCN) | |
| C. | pH=8的溶液中:c(Na+)+c(H+)+c(HCN)=0.1mol•L-1+c(OH-) | |
| D. | 将0.3 mol•L-1HCN溶液和0.2 mol•L-1NaOH溶液等体积混合(忽略溶液体积变化):c(CN-)+3c(OH-)=2c(HCN)+3c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 66 | 70 | 143 | 160 |
| 主要化合价 | -2 | +5、+3、-3 | +3 | +2 |
| A. | X和Y能形成多种共价化合物 | |
| B. | 最简单氢化物的沸点:X>Y | |
| C. | 工业上常用电解Z的氯化物水溶液的方法制备Z单质 | |
| D. | Z和W的氧化物均能溶于Y的最高价氧化物对应的水化物溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com