
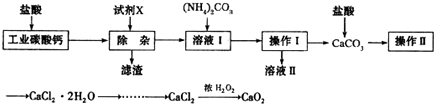
分析 (1)调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,可以使之转化为氢氧化物沉淀而除去,根据保证不引入杂质离子来选择合适的调节pH值的试剂;
(2)根据蒸发操作所需仪器来回答;
(3)根据双氧水受热易分解来回答.
解答 解:(1)调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,可以使之转化为氢氧化物沉淀而除去滤渣的主要成分是氢氧化铝和氢氧化铁,为了保证不引入杂质离子,所以中和盐酸的酸性调节pH值可以用氧化钙或是碳酸钙,而NH3•H2O 和Ba(OH)2会引入杂质;
故答案为:Fe(OH)3、Al(OH)3;AB;
(2)根据蒸发操作所需仪器有玻璃棒、蒸发皿、酒精灯、三脚架,
故答案为:蒸发皿、玻璃棒;
(3)温度过高会导致双氧水分解,引起实验误差,所以由CaCl2制取CaO2的反应中,温度不宜太高;
故答案为:防止温度过高H2O2发生分解.
点评 本题考查了物质的制备方案设计、物质的分离提纯和除杂,题目难度中等,要求学生具有分析和解决问题的能力.


科目:高中化学 来源: 题型:解答题
 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 1000 | 1500 |
| C(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
| A. | 500 s时O2的浓度为0.075 mol/L | |
| B. | 平衡后,升高温度,正反应速率先增大后减小 | |
| C. | 平衡后,要使平衡常数增大,改变的条件是升高温度 | |
| D. | 1000 s时将容器的体积缩小一半,重新达到平衡时0.25 mol/L<c(N2O5)<0.50 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com