
某化学兴趣小组拟用下图装置测定某粗锌样品中锌的质量分数。他们查阅资料后获知该粗锌样品中的其他成分不能与稀盐酸反应。请填写以下实验报告。
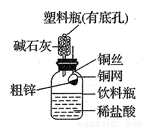
(1)实验目的: 。
(2)实验步骤:
①称取10.0g粗锌置于铜网中,按图示装置组装后,称得仪器和药品总质量为120.0g。
②将铜网插入足量的稀盐酸中,有关反应的化学方程式为 。
③反应完全后,称得装置总质量为119.8g,则粗锌中锌的质量分数为 。
(3)问题探究:(已知碱石灰是NaOH和CaO的混合物,常用于干燥、吸收气体)
①该实验若不用碱石灰,则所测得的粗锌中锌的质量分数将 (填“偏大”、“偏小”或“无影响”);
②若将粗锌换成某含有杂质的石灰石样品(杂质也不与稀盐酸反应),判断该实验方案能不能用于石灰石样品中CaCO3质量分数的测定,并说明理由____________________。
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中肯定不含非极性共价键 | B. | 原子晶体的熔点肯定高于其他晶体 | ||
| C. | 由分子组成的物质其熔点一定较低 | D. | 构成晶体的粒子一定含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;△\;}}{\;}$SO2↑+Cl2↑ |
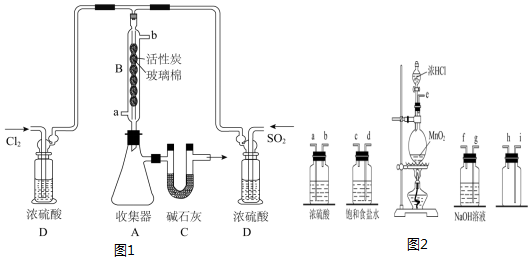
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水。得到的溶液每亳升质量为q g,物质的量浓度为c。则溶质的相对分子质量为( )
A. 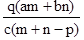 B.
B. 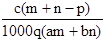 C.
C. 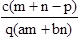 D.
D. 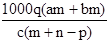
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
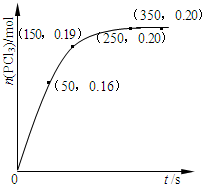 温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% | |
| D. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | 工业固氮N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
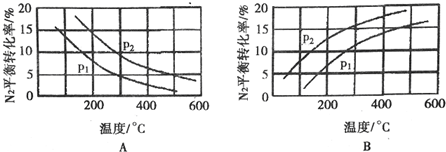
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
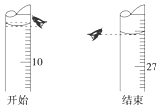 某同学欲用已知物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某同学欲用已知物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定 | 待测溶液 体积/mL | 标准酸体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 10.00 | V1 | V2 |
| 第二次 | 10.00 | 4.10 | 21.10 |
| 第三次 | 10.00 | 0.40 | 17.60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com