
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量为2∶1时,则反应中Cu2S与被还原的HNO3的物质的量之比为( )
| A.1∶6 | B.1∶7 | C.1∶8 | D.1∶9 |
科目:高中化学 来源: 题型:单选题
有Fe2+、NO3-、Fe3+、NH4+、H+ 和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A.氧化剂与还原剂的物质的量之比为8︰l |
| B.还原产物为NH4+ |
| C.若有l mol NO3-参加还原反应,则转移8mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应既属于氧化还原反应,又属于化合反应的的是
A.2Fe+3Cl2 2FeCl3 2FeCl3 | B.Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 |
| C.CaO+CO2=CaCO3 | D.H2SO4+2NaOH = Na2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3 +3F2=NF3 +3NH4F,它在潮湿的环境中能发生反应:
3 NF3+5H2O=2NO+HNO3+9HF。下列说法正确的是( )
| A.制取NF3的反应中,氧化剂与还原剂的物质的量之比为1:3 |
| B.NF3在潮湿的空气中泄漏会产生红棕色气体 |
| C.若在制取NF3的反应中有2molNH3参加反应,转移电子的物质的量为12mol |
| D.它在潮湿的环境中NF3是氧化剂,H2O是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NO2通过盛有水的洗气瓶,转移0.03mol电子时,参加反应的NO2气体在标准状况下的体积为
| A.224mL | B.336mL | C.448mL | D.672mL |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于3Cl2 + 6KOH  KClO3 + 5KCl + 3H2O反应,以下说法正确的是 ( )
KClO3 + 5KCl + 3H2O反应,以下说法正确的是 ( )
| A.Cl2是氧化剂,KOH是还原剂 |
| B.被氧化的氯元素的质量为被还原的氯元素质量的5倍 |
| C.3mol氯气参加反应转移10mol电子 |
| D.KOH既不是氧化剂,又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知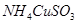 与足量的2mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是( )
与足量的2mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是( )
| A.反应中硫酸作氧化剂 |
B.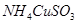 中硫元素被氧化 中硫元素被氧化 |
C.1mol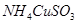 完全反应转移0.5mol电子 完全反应转移0.5mol电子 |
| D.刺激性气味的气体是氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知M2O7x-与S2-在酸性溶液中能发生反应:M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则
M2O7x-中M元素的化合价是( )
| A.+2 | B.+3 | C.+4 | D.+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据下列反应判断氧化剂的氧化性由强到弱的顺序,正确的是
①Cl2+2KI=I2+2KCl ②2FeCl3+2HI=I2+2FeCl2+2HCl
③2FeCl2+Cl2=2FeCl3 ④I2+SO2+2H2O=2HI+H2SO4
| A.Cl2>I2>Fe3+>SO24- | B.Cl2>Fe3+>I2>SO24- |
| C.Fe3+>Cl2>I2>SO24- | D.Cl2>Fe3+>SO24->I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com