
| A. | 乙烷 | B. | 溴乙烷 | C. | 乙醇 | D. | 乙醛 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由乙烯、氢气制取乙烷,由乙烷、溴(气体)制溴乙烷 | |
| B. | 乙烯使溴水褪色,乙炔使酸性高锰酸钾水溶液褪色 | |
| C. | 乙醇、乙酸制乙酸乙酯,由甘氨酸制得二肽 | |
| D. | 由乙烯制取聚乙烯,由甲醛、苯酚制取酚醛树脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


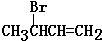 .
. (注明反应条件).在碱性条件下,由Ⅳ与
(注明反应条件).在碱性条件下,由Ⅳ与 反应合成Ⅱ,其反应类型为取代反应.
反应合成Ⅱ,其反应类型为取代反应. (写出其中一种).
(写出其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a | |||||||
| d | f | g | |||||
| b | c | e | h | ||||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | d>b>c>a | B. | c>d>a>b | C. | d>a>b>c | D. | c>d>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
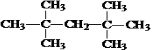
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com