
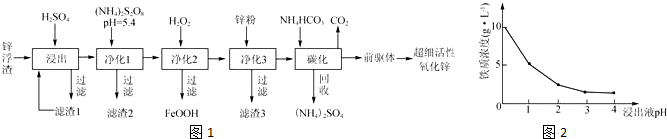
分析 锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,加入稀硫酸浸出过滤,得到滤渣Ⅰ为SiO2 ,净化Ⅰ加入(NH4)2S2O8溶液,PH=5.4是为了将Mn2+转化为MnO2而除去,过滤得到滤渣Ⅱ为MnO2,滤液在加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH沉淀铁离子生成FeOOH,过滤得到滤液中加入锌置换铬,过滤得到的金属位Cd,滤液中加入碳酸氢铵碳化,得到硫酸铵和二氧化碳及“前躯体”的化学式为ZnCO3•2Zn(OH)2•H2O,制备得到超细活性氧化锌;
(1)滤渣Ⅰ进行再次浸出的目的是提高锌元素的浸出率;锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,加入稀硫酸浸出过滤发生的反应为:Zn、ZnO和硫酸发生的反应;
(2)(NH4)2S2O8溶液,PH=5.4是为了将Mn2+转化为MnO2而除去,发生氧化还原反应;
(3)依据铁离子水解显酸性分析,氢离子浓度大有利于抑制铁离子的水解;
(4)上述分析可知滤渣3为被还原出的Cd;
(5)依据“前躯体”的化学式为ZnCO3•2Zn(OH)2•H2O,结合反应物为硫酸锌和碳酸氢铵,利用原子守恒配平书写化学方程,碳化时所用NH4HCO3的实际用量为理论用量的1.1倍,其原因一是为了使Zn2+充分沉淀,碳酸氢铵受热分解损失.
解答 解:由工业生产流程可知,锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,加入稀硫酸浸出过滤,得到滤渣Ⅰ为SiO2 ,净化Ⅰ加入(NH4)2S2O8溶液,PH=5.4是为了将Mn2+转化为MnO2而除去,过滤得到滤渣Ⅱ为MnO2,滤液在加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH沉淀铁离子生成FeOOH,过滤得到滤液中加入锌置换铬,过滤得到的金属位Cd,滤液中加入碳酸氢铵碳化,得到硫酸铵和二氧化碳及“前躯体”的化学式为ZnCO3•2Zn(OH)2•H2O,制备得到超细活性氧化锌;
(1)锌浮渣利用硫酸浸出后,滤渣Ⅰ进行再次浸出的目的是提高锌元素的浸出率,Zn、ZnO和硫酸发生的反应的化学方程式为:Zn+2H+=Zn2++H2↑,ZnO+2H+=Zn2++H2O
故答案为:提高锌元素的总浸出率;Zn+2H+=Zn2++H2↑,ZnO+2H+=Zn2++H2O;
(2)(NH4)2S2O8溶液具有氧化性,在PH=5.4时是为了将Mn2+转化为MnO2而除去,发生氧化还原反应,反应的离子方程式为:Mn2++S2O82-+2H2O=MnO2↓+2SO42-+4H+;
故答案为:Mn2++S2O82-+2H2O=MnO2↓+2SO42-+4H+;
(3)90℃时,净化2溶液中残留铁的浓度受pH影响如图2pH值较小时,虽有利于Fe2+转化为Fe3+,但残留铁的浓度仍高于pH为3~4时的原因是,依据铁离子水解显酸性可知,氢离子浓度大有利于抑制铁离子的水解;
故答案为:H+抑制Fe3+水解;
(4)上述分析可知发生Zn+Cd2+=Zn2++Cd,滤渣3为被还原出的Cd,故答案为:Cd;
(5)“前躯体”的化学式为ZnCO3•2Zn(OH)2•H2O,结合反应物为硫酸锌和碳酸氢铵,滤液中加入碳酸氢铵碳化,得到硫酸铵和二氧化碳及“前躯体”的化学式为ZnCO3•2Zn(OH)2•H2O,利用原子守恒配平书写化学方程为:3ZnSO4+6NH4HCO3=ZnCO3•2Zn(OH)2•H2O↓+3(NH4)2SO4+5CO2↑,碳化时所用NH4HCO3的实际用量为理论用量的1.1倍,其原因一是为了使Zn2+充分沉淀,碳酸氢铵受热分解损失或NH4HCO3消耗H+,避免H+浓度过大溶解ZnCO3•2Zn(OH)2•H2O,
故答案为:3ZnSO4+6NH4HCO3=ZnCO3•2Zn(OH)2•H2O↓+3(NH4)2SO4+5CO2↑;碳酸氢铵受热分解损失或NH4HCO3消耗H+,避免H+浓度过大溶解ZnCO3•2Zn(OH)2•H2O.
点评 本题考查了物质提纯和分离的工业制备流程分析判断,实验过程的分析应用,主要是物质性质的理解应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
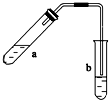 可用图示装置制取少量乙酸乙酯(部分图中均已略去).请填空:
可用图示装置制取少量乙酸乙酯(部分图中均已略去).请填空:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

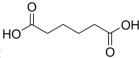 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如图:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时,1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸和碱反应生成1mol水时所放出的热 | |
| B. | 1mol酸和1mol碱反应生成盐和水时所放出的热 | |
| C. | 强酸稀溶液和强碱稀溶液反应生成1mol液态水时所放出的热 | |
| D. | 稀Ba(OH)2和稀H2SO4完全反应生成1mol水时所放出的热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,分子式为C6H8O6;其中的-OH叫羟基(填官能团名称).在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是蓝色褪去,说明维生素C有还原性(填氧化性或还原性).
,分子式为C6H8O6;其中的-OH叫羟基(填官能团名称).在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是蓝色褪去,说明维生素C有还原性(填氧化性或还原性).查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com