

分析 G是红棕色气体,则G是NO2;F和氧气反应生成二氧化氮,所以F是NO;二氧化氮和水反应生成H是HNO3;A是酸式盐,A和氢氧化钠反应生成E,E和氧气反应生成NO,则E是NH3;B能使品红溶液褪色,且B能和氧气反应生成C,所以B是SO2,C是SO3;三氧化硫和水反应生成D为H2SO4,A是酸式盐且是铵盐,所以A是NH4HSO3,据此分析解答.
解答 解:G是红棕色气体,则G是NO2,F和氧气反应生成二氧化氮,所以F是NO,二氧化氮和水反应生成H是HNO3.A是酸式盐,和氢氧化钠反应生成E,E和氧气反应生成NO,则E是NH3.B能使品红溶液褪色,且B能和氧气反应生成C,所以B是SO2,C是SO3,三氧化硫和水反应生成D为H2SO4,A是酸式盐且是铵盐,所以A是NH4HSO3,
(1)通过以上分析知,A、B分别是NH4HSO3、SO2,二氧化硫属于酸性氧化物,能和水反应生成亚硫酸,亚硫酸不稳定,易被空气氧化生成硫酸,随雨水降落地面而形成酸雨,所以其一种危害是形成酸雨,
故答案为:NH4HSO3;SO2;酸雨;
(2)氨气和氧气在高温高压催化剂条件下发生氧化还原反应生成NO和水,反应方程式为:4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O;
C和浓硫酸在加热条件下反应生成二氧化硫、二氧化碳和水,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
H的浓溶液为浓硝酸,铜和浓硝酸反应生成硝酸铜、二氧化氮和水,反应的离子方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,
故答案为:4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O;C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(3)A中含有的阳离子为铵根离子,铵根离子检验方法是:取该溶液少许滴加NaOH溶液,加热,若生成的气体能使润湿的红色石蕊试纸变蓝,则证明有NH4+,
故答案为:取该溶液少许滴加NaOH溶液,加热,若生成的气体能使润湿的红色石蕊试纸变蓝,则证明有NH4+.
点评 本题考查无机物推断,为高频考点,侧重考查学生推断分析判断能力,明确常见物质性质及物质之间转化是解本题关键,注意掌握常见离子检验方法及浓硫酸、硝酸的性质,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,将浓度均为0.1mol/L CH3COOH溶液和HX溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,则下列说法正确的是( )
25℃时,将浓度均为0.1mol/L CH3COOH溶液和HX溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,则下列说法正确的是( )| A. | 电离平衡常数:CH3COOH>HX>H2CO3 | |
| B. | 将pH=2的CH3COOH溶液和HX溶液稀释10倍后,水电离出的c (H+)较大的为HX溶液 | |
| C. | 往10ml 0.1mol/L的Na2CO3溶液中缓慢滴加10ml 0.1mol/L的HX,混合后的离子浓度大小关系:c (Na+)>c (HCO3-)>c (X-)>c (OH-)>c (H+) | |
| D. | 将浓度均为0.1mol/L的CH3COOH和HX的混合液用标准氢氧化钠溶液滴定,至中性时,CH3COOH被完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
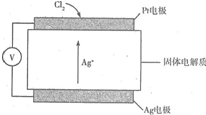 C12是一种重要的化工原料,氯气含量检测仪是检测Cl2是否泄漏不可或缺的安全性仪器,其工作原理如图所示,下列有关说法错误的是( )
C12是一种重要的化工原料,氯气含量检测仪是检测Cl2是否泄漏不可或缺的安全性仪器,其工作原理如图所示,下列有关说法错误的是( )| A. | Pt电极为正极 | |
| B. | 电子从Ag电极经外电路流向Pt电极 | |
| C. | Ag电极的电极反应式是Cl2+2e-+2Ag+=2AgCl | |
| D. | 当电路中转移2 mol电子时,消耗1 mol Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基与烃基或苯环侧链上的碳原子相连的化合物称为醇 | |
| B. | 酚类和醇类具有相同的官能团,因而具有相同的化学性质 | |
| C. | 乙二醇和丙三醇都是无色液体,均易溶于水和乙醇 | |
| D. | 相对分子质量相近的醇和烷烃相比,醇的沸点高于烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、HCO3-、Cl- | B. | Cu2+、Mg2+、SO42-、Cl- | ||
| C. | CH3COO-、Cl-、NO3-、K+ | D. | NO3-、Na+、Cl-、Ba2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com