

| n |
| V |
 ,故答案为:
,故答案为: ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、油脂是人体所需的基本营养物质之一,应尽量多食用油脂类物质 |
| B、糖尿病病人有糖分从尿液中排出,应多食用葡萄糖来补充 |
| C、营养物质并不是摄入越多越好,平时要注意膳食平衡 |
| D、高血压、高血脂的病人要尽量少食高脂肪食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
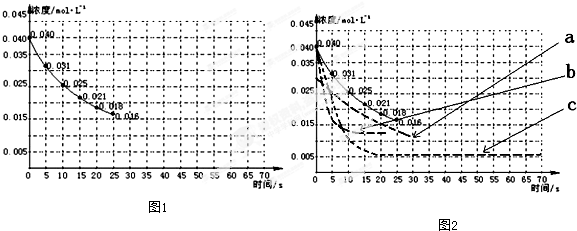
| 实验编号 | CO2起始浓度/mol?L-1 | 反应温度/℃ | 反应压强/kPa | 是否加入催化剂 |
| A | 0.030 | 150 | 101 | 否 |
| B | 0.040 | 150 | 101 | 否 |
| C | 0.040 | 250 | 101 | 是 |

| 弱酸化学式 | HC1O | H2CO3 |
| 电离平衡常数 | 4.7×l0-8 | Ka1= |
| c(Cd2+) |
| c(ca2+) |
| KsP(CdCO3) |
| Ksp(CaCO3) |
| c(Cd2+) |
| c(Ca2+) |
| Ksp(CdCO3) |
| Ksp(CaCO3) |
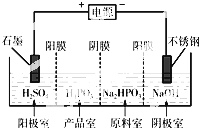
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油分馏所得的馏分是一种具有固定熔沸点的纯净物 |
| B、石油裂化的主要目的是提高汽油等轻质油的产量 |
| C、石油裂解的原料是石油分馏产物,包括石油气 |
| D、石油在催化剂的作用下加热,可以使链状烃化为环状烃(如苯、甲苯) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的结构简式为CH2CH2 |
B、羟基的电子式: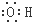 |
C、Ca2+的结构示意图为 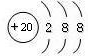 |
| D、乙醇的分子式:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ②CH3CH2CH2OH ③CH≡C-CH2OH ④CH2=CH-COOCH3⑤CH2=CH-COOH中,既能发生加成反应和酯化反应,又能发生氧化反应的是( )
②CH3CH2CH2OH ③CH≡C-CH2OH ④CH2=CH-COOCH3⑤CH2=CH-COOH中,既能发生加成反应和酯化反应,又能发生氧化反应的是( )| A、③⑤ | B、①③⑤ | C、②④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X |
| X |
| A、若A是一种淡黄色固体,B是造成酸雨的“罪魁祸首”,则X为O2 |
| B、若B与新制氢氧化铜共热,有砖红色沉淀生成,且C能使湿润的蓝色石蕊试纸变红,则A和C可以反应生成酯 |
| C、若B为两性氢氧化物,则C中一定存在Al3+ |
| D、A既可以为金属单质,也可以为非金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.| 氖 | 氧 | 溴 | 碘 | |
| 第一电离能 (Kj/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应速率减慢,产生H2的量不变 |
| B、反应速率加快,产生H2的量不变 |
| C、反应速率不变,产生H2的量略增加 |
| D、反应速率加快,产生H2的量略减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com