
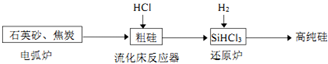
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
分析 (1)二氧化硅是光导纤维的主要成分;
(2)依据生产玻璃的主要原料有石灰石、石英和纯碱解答;
(3)二氧化硅与碳在高温条件下反应生成硅和一氧化碳;
①粗硅与氯化氢反应生成三氯硅烷和氢气、氯化氢;
②分子结构为正四面体的物质,则其形成的化学键应完全相同,结合给出分子的结构特点分析;
③根据题中数据,采用精馏(或蒸馏)方法提纯SiHCl3;SiHCl3水解生成硅酸、氢气和氯化氢.
解答 解:(1)光导纤维的主要成分是二氧化硅,化学式为:SiO2;
故答案为:SiO2;
(2)生产玻璃的主要原料有石灰石、石英和纯碱;
故答案为:石英砂、纯碱、石灰石;
(3)①二氧化硅与碳在高温条件下反应生成硅和一氧化碳,化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑;
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO↑;
②粗硅与氯化氢反应生成三氯硅烷和氢气、氯化氢,化学方程式:2Si(粗硅)+6HCl=2SiHCl3+2H2↑;
故答案为:2Si(粗硅)+6HCl=2SiHCl3+2H2↑;
②SiCl4、SiH2Cl2、SiH3Cl这几种物质中,只有四氯化硅中四个化学键完全相同,为空间正四面体结构;
故答案为:四氯化硅或四氯硅烷;
③利用沸点的不同提纯SiHCl3属于蒸馏,SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),由于沸点差别较大,可以通过精馏除去杂质;SiHCl3水解反应方程式为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑,生成硅酸、氢气和氯化氢,
故答案为:故答案为:精馏;H4SiO4(或H2SiO3)、H2、HCl.
点评 本题考查了实验方案设计的有关知识,侧重考查了硅及其化合物的有关知识,明确二氧化硅的性质及粗硅提纯的原理即可解答,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全灭活该病毒感染性,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | 2015年初公益调查《柴静雾霾调查:穹顶之下》发布,引起社会强烈反响.雾霾中PM2.5属于胶体 | |
| C. | 分光光度计可以用来测定某些化学反应的反应速率 | |
| D. | 汽油、煤油、植物油都是油,但它们的主要成分不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
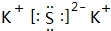 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的物质一定是共价化合物 | |
| B. | 分子中只有共价键的化合物一定是共价化合物 | |
| C. | 离子化合物中一定没有共价键 | |
| D. | 离子化合物一定含有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 测定次数 | 第一次 | 第二次 | 第三次 |
| 初始读数(mL) | 0.40 | 0.90 | 0.00 |
| 终点读数(mL) | 25.05 | 21.00 | 19.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
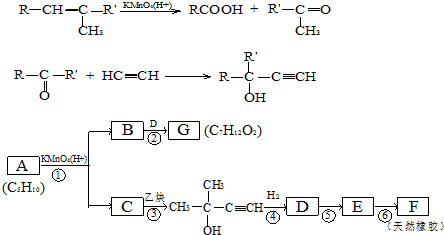
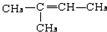 ,CCH3COCH3,ECH2=C(CH3)CH=CH2
,CCH3COCH3,ECH2=C(CH3)CH=CH2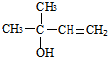 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$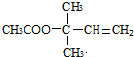 +H2O;
+H2O; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M:MaOH X:CO2 | B. | M:HNO3 X:Fe | C. | M:S X:O2 | D. | M:Al X:NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 在上述五种元素形成的单质中,X元素可形成几种同素异形体 | |
| C. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定没有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| AgCl | Agl | Ag2S | |
| KSP(单位省略) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
| A. | 沉淀转化的实质就是沉淀溶解平衡的移动 | |
| B. | 溶解度小的沉淀可以转化为溶解度更小的沉淀 | |
| C. | AgCl固体在等物质的量浓度的NaCl、CaCl2 溶液中的溶解度相同 | |
| D. | 25℃时,在饱和AgCl、Agl、Ag2S溶液中,所含Ag+的浓度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com