

 CO↑+H2O;
CO↑+H2O; CO↑+H2O;
CO↑+H2O; Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;
Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2; Cu+CO2,固体质量减少△m
Cu+CO2,固体质量减少△m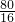 ×0.2g=1g,
×0.2g=1g,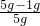 ×100%=80%;
×100%=80%; Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;(3)实验步骤:先通入CO一会儿后,加热待反应管内的药品完全后,停止加热,然后继续通入CO到玻璃管冷却为止;
Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;(3)实验步骤:先通入CO一会儿后,加热待反应管内的药品完全后,停止加热,然后继续通入CO到玻璃管冷却为止;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
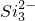 +2H+═H2SiO3↓
+2H+═H2SiO3↓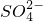 +3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓
+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓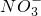 +6H+
+6H+ Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 将一定量Mg、Al合金溶于1mol?L-1的HCl溶液中,进而向所得溶液中滴加1mol?L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液体积(mL)的图示如下.下列分析的结论中正确的是
将一定量Mg、Al合金溶于1mol?L-1的HCl溶液中,进而向所得溶液中滴加1mol?L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液体积(mL)的图示如下.下列分析的结论中正确的是查看答案和解析>>
科目:高中化学 来源: 题型:单选题
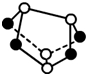 )含有5NA个S-S键
)含有5NA个S-S键查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com