
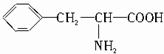 ,B的结构简式为
,B的结构简式为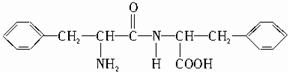 .
. 分析 天然蛋白质水解产物中含有的一定是α-氨基酸,能与NaOH反应,也能与盐酸反应,氨基酸之间发生脱水所和反应会生成二肽和水,B的相对分子质量为312,则可以推知A的相对分子质量是165,当与浓硝酸反应时显黄色,说明有机物质中含有苯环,据此来回答判断.
解答 解:天然蛋白质水解产物中含有的一定是α-氨基酸,α-氨基酸能与NaOH反应,也能与盐酸反应,在一定条件下,两分子氨基酸之间发生脱水所和反应会生成二肽B和水,B的相对分子质量为312,则可以推知A的相对分子质量是165,当与浓硝酸反应时显黄色,说明有机物质中含有苯环,
设A的结构简式为 ,则:(12×6+5)+14n+13+16+45=165,解得:n=1,
,则:(12×6+5)+14n+13+16+45=165,解得:n=1,
所以A的结构简式为: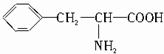 ;
;
两分子的该α-氨基酸之间反应生成的B,则B为: ,
,
故答案为: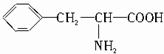 ;
; .
.
点评 本题考查有机物分子式、结构简式的确定,题目难度中等,明确蛋白质、氨基酸的性质为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:多选题
| A. | Ag+,SO42-,NO3-,K+ | B. | Na+,HCO3-,Ba2+,NO3- | ||
| C. | Cl-,CO32-,Na+,Ca2+ | D. | Mg2+,SO42-,Na+,Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用小苏打类药物治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| B. | FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 它的分子式为C8H10 | B. | 与苯乙烯是同分异构体 | ||
| C. | 能发生加成反应 | D. | 它的二氯代物共有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4是氧化剂,Fe2+是还原剂 | |
| B. | 每生成1mol NO,则转移电子数为2mol | |
| C. | 参加反应的氧化剂与还原剂的物质的最之比为28:3 | |
| D. | 若有3mol Fe3O4被氧化,则被还原的HNO3为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲=乙=丙 | B. | 丙>乙>甲 | C. | 乙>丙>甲 | D. | 甲=丙>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com