
| A. | 得到2.54g沉淀时,加入Na0H溶液的体积是600ml | |
| B. | 该浓硝酸稀释至100mL时,HNO3的物质的量浓度是7mol•L-1 | |
| C. | 该合金中镁与铜的质量之比是3:16 | |
| D. | NO2和N2O4的混合气体中,N2O4的物质的量是0.01mol |
分析 金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为:2.54g-1.52g=1.02g,氢氧根的物质的量为:$\frac{1.02g}{17g/mol}$=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{2x+2y=0.06}\\{64x+24y=1.52}\end{array}\right.$,解得:x=0.02,y=0.01,
A.反应后溶质为硝酸钠,根据氮元素守恒计算硝酸钠的物质的量,根据钠离子守恒可知n(NaOH)=n(NaNO3),再根据V=$\frac{n}{c}$计算需要氢氧化钠溶液的体积;
B.根据c=$\frac{1000ρω}{M}$计算该浓硝酸的物质的量浓度,然后根据稀释过程中溶质的物质的量不变计算出稀释后硝酸溶液浓度;
C.根据分析计算出该合金中镁与铜的质量之比;
D.根据n=$\frac{V}{{V}_{m}}$计算NO2和N2O4混合气体的物质的量,设二氧化氮的物质的量为amol,根据电子转移列方程计算.
解答 解:金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为:2.54g-1.52g=1.02g,氢氧根的物质的量为:$\frac{1.02g}{17g/mol}$=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{2x+2y=0.06}\\{64x+24y=1.52}\end{array}\right.$,解得:x=0.02,y=0.01,
A.反应后溶质为硝酸钠,根据氮元素守恒可知,硝酸钠的物质的量为0.05L×14mol/L-0.04mol-(0.05-0.04)×2=0.64mol,根据钠离子守恒可知n(NaOH)=n(NaNO3)=0.64mol,故需要氢氧化钠溶液的体积为:$\frac{0.64mol}{1mol/L}$=0.64L=640mL,故A错误;
B.该浓硝酸密度为1.40g/mL、质量分数为63%,故该浓硝酸的物质的量浓度为:$\frac{1000×1.4×63%}{63}$mol/L=14mol/L,将50mL该浓硝酸稀释至100mL时,溶液浓度变为原先的一半,为7mol/L,故B正确
C.该合金中镁与铜的物质的量之比=(24g/mol×0.01mol):(64g/mol×0.02mol)=3:16,故C正确;
D.NO2和N2O4混合气体的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,设二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,则四氧化二氮的物质的量为:0.05mol-0.04mol=0.01mol,故D正确;
故选A.
点评 本题考查混合物的有关计算、氧化还原反应的计算,题目难度中等,理解反应发生的过程是关键,是对学生综合能力的考查,注意根据守恒思想进行的解答,试题培养了学生的分析能力及化学计算能力.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2都能与碱及碱性氧化物反应 | |
| B. | CO2和SiO2都能与水反应生成相应的酸 | |
| C. | CO2和SiO2都能与焦炭反应生成CO | |
| D. | SiO2可用于制光导纤维,干冰可用于人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y和Z可以组成一种Y和Z的质量比为7:20的化合物 | |
| B. | X、Y、Z组成的一种离子化合物,其中X、Y、Z元素原子个数比可能为4:2:3 | |
| C. | X和Z可以形成X2Z和X2Z2型化合物,所含共价键类型不完全相同 | |
| D. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
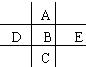 如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题: .A单质的电子式为
.A单质的电子式为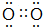 .
.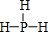 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3 | B. | FeO | C. | Fe(OH)2 | D. | Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水洗涤试管内壁上的“银镜” | |
| B. | 只用溴水鉴别苯、CCH4、KI溶液、Na2SO4溶液 | |
| C. | 为加快过滤速度,用玻璃棒搅拌过滤器中的食盐水 | |
| D. | 为迅速除去乙酸乙酯中的少量乙酸,加入足量NaOH溶液并加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水是指氯气的水溶液 | |
| B. | 在pH试纸上滴新制氯水,试纸会先变红后褪色 | |
| C. | 久置的氯水漂白作用更强 | |
| D. | 新制氯水应避光保存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com