
| A. | Na2O2可作供氧剂,而Na2O不行 | |
| B. | 钠在常温下不容易被氧化 | |
| C. | Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 | |
| D. | 钠在氯气中燃烧,生成白色的烟雾 |
分析 A.过氧化钠与水、二氧化碳反应生成产物都有氧气,氧化钠与水、二氧化碳反应不会产生氧气;
B.钠性质活泼,极易被氧气、水蒸气氧化;
C.碱性氧化物与水反应只生成碱;
D.钠在氯气中生成固体氯化钠.
解答 解:A.过氧化钠与水、二氧化碳反应生成产物都有氧气,氧化钠与水、二氧化碳反应不会产生氧气,所以过氧化钠可以做供氧剂,故A正确;
B.钠性质活泼,极易被氧气、水蒸气氧化,故B错误;
C.过氧化钠与水反应生成氢氧化钠和氧气,不符合碱性氧化物概念,不属于碱性氧化物,故C错误;
D.钠在氯气中生成固体氯化钠,所以只能看到白烟,故D错误;
故选:A.
点评 本题考查了元素化合物知识,熟悉钠及其化合物的性质是解题关键,注意碱性氧化物的概念,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②③ | C. | ③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提出问题 | B. | 获得结论 | C. | 猜想 | D. | 反思 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学方程式 | F2+H2?2HF | H2+Cl2?2HCl | H2+Br2(g)?2HBr | H2+I2(g)?2HI(g) |
| 平衡常数K(t1) | 1.8×1036 | 9.7×1012 | 5.6×107 | 43 |
| 平衡常数K(t2) | 1.9×1032 | 4.2×1011 | 9.3×106 | 34 |
| A. | 只有ab | B. | 只有abe | C. | 只有abce | D. | abcde |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
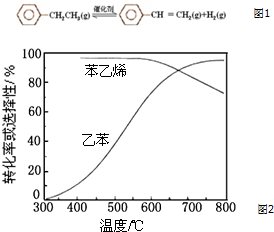 乙苯催化脱氢制苯乙烯反应如图1:
乙苯催化脱氢制苯乙烯反应如图1:| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | X | 348 | 612 | 436 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com