
比较下列各组热化学方程式中ΔH的大小关系。
(1)S(s)+O2(g)===SO2(g) ΔH1
S(g)+O2(g)===SO2(g) ΔH2
ΔH1______ΔH2
(2)CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2
ΔH1______ΔH2
(3)煤作为燃料有两种途径:
途径1——直接燃烧
C(s)+O2(g)===CO2(g) ΔH1<0
途径2——先制水煤气
C(s)+H2O(g)===CO(g)+H2(g) ΔH2>0
再燃烧水煤气:
2CO(g)+O2(g)===2CO2(g) ΔH3<0
2H2(g)+O2(g)===2H2O(g) ΔH4<0
ΔH1、ΔH2、ΔH3、ΔH4的关系式是______________________________________。
科目:高中化学 来源: 题型:
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
A.若R(OH)n为强碱,则W(OH)(n+1)也为强碱
B.若HnXOm为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为-2,则Z的最高正化合价为+6
D.若X的最高正化合价为+5,则五种元素都是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.14g乙烯和丁烯的混合物中含有的原子总数为3NA个
B.标准状况下,22.4L己烷中共价键数目为19NA
C.1mol苯乙烯(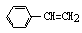 )中含有的C=C数为4NA
)中含有的C=C数为4NA
D.7g CnH2n中含有的氢原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。
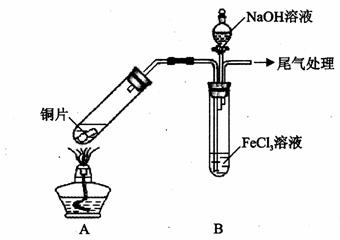
(1)实验前,应先检查装置的 ;实验中产生的尾气应通人 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、玻璃棒、 。
(3)该小组同学向5mL lmol/L FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是 。
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
【查阅资料】Fe( HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO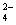 。Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
。Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验:

向步骤①和步骤②所得溶液中加入某种试剂,溶液立即出现蓝色沉淀,则该试剂中含有溶质的化学式是 。
(6)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ. 。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下3个热化学方程式
2H2S(g)+3O2(g)===2SO2(g)+2H2O(l) ΔH=-Q1 kJ·mol-1
2H2S(g)+O2(g)===2S(s)+2H2O(l) ΔH=-Q2 kJ·mol-1
2H2S(g)+O2(g)===2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1
判断Q1、Q2、Q3三者关系正确的是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
在铁片上镀银时,下列叙述中正确的是( )
①将铁片接在电源的正极上 ②将银片接在电源的正极上 ③在铁片上发生的反应是Ag++e-—→Ag ④在银片上发生的反应是4OH-—→O2↑+2H2O+4e-
⑤可用硫酸亚铁溶液做电镀液 ⑥可用硝酸银溶液为电镀液
A.①③⑥ B.②③⑥ C.①④⑤ D.②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
对于一日三餐的食谱编制说法错误的是 ( )。
A.早餐应吃一些营养价值高、少量而精的食品
B.午餐主食量要大些、品质要高些,副食花样要多些
C.晚餐进食量要适当小些
D.三餐饮食只要口味合适即可
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com