
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)Ⅰ.从下列各组反应对比,判断哪种微粒的氧化性最强。
(1)在氯气中Fe锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液FeCl2。则氯气分子、氢离子、氯离子中,__________具有氧化性,__________氧化性最强。请书写出以上各反应的化学方程式___________________________。
(2)已知在ⅣA族元素中,Pb2+和Sn4+的化合物较为稳定。
据此可判断PbO2具有较强的________性,SnCl2具有较强的________性;写出PbO2溶于盐酸的离子方程式____________________;写出SnCl2和FeCl3溶液混合的离子方程式_______________________________________
Ⅱ.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40°C~50°C时反应可生成它。CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+===Cu2++Cu。
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作________(填“氧化剂”或“还原剂”)。
(2)写出CuH在氯气中燃烧的化学反应方程式:________________。
(3)CuH溶解在稀盐酸中生成的气体是____________(填化学式)。
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式: ______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成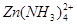 。
。
回答下列问题:
(1)写出锌和氢氧化钠溶液反应的化学方程式
___________________________________________________ 。
(2)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水
③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(3)写出可溶性铝盐与氨水反应的离子方程式
______________________________________________________ 。
(4)试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因
__________________________________________ ________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省长沙市高三第二次月考化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中,可能大量共存的是( )
①溶有足量氨气的无色溶液中:K+,NH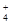 ,Na+,HSO
,Na+,HSO ,PO
,PO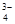 ,MnO
,MnO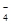
②能使pH试纸变深蓝色的溶液中:K+,Na+,AlO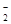 ,NO
,NO ,S
,S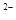 ,SO
,SO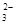
③水电离的H+浓度c(H+)=10-13mol·L-1的溶液中:Cl ,CO
,CO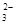 ,S2O
,S2O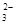 ,Fe3+,K+,Na+
,Fe3+,K+,Na+
④加入Al能放出H2的溶液中:Na+,NH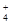 ,K+,SO
,K+,SO ,Cl
,Cl ,Br
,Br
⑤使石蕊变红的溶液中:Fe3+,Na+,K+,NO ,SO
,SO ,Cl
,Cl
⑥室温下下pH=1的溶液中:Fe2+,Al3+,K+,Na+,NO ,I
,I ,Cl
,Cl ,S
,S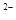
⑦含有大量Fe3+的溶液:K+,NH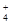 ,Na+,SCN
,Na+,SCN ,I
,I ,Br
,Br
⑧室温下, =0.1 mol/L的溶液中:Na+,K+,SO
=0.1 mol/L的溶液中:Na+,K+,SO ,SiO
,SiO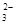 ,NO
,NO
A.①③④⑥ B.①③⑥⑦ C.②④⑤⑧ D.②⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学选修6 4.1物质性质的研究练习卷(解析版) 题型:填空题
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成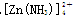 。
。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为________(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式
________________________________________________________________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是________。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式
________________________________________________________________________。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备Zn(OH)2的原因
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com