
分析 (1)①硫元素是16号元素,原子核外有三个电子层,最外层6个电子,依据周期表结构判断位置;
②硫元素最高价为+6价,最高价氧化物对应的水化物为硫酸;
③Na3AsO4溶液与Zn反应生成AsH3,As元素化合价最高价+5价变化为-3价,化合价降低做氧化剂,锌做还原剂;
(2)根据反应物和生成物来分析反应,则利用氧化还原反应反应中得失电子守恒来分析完全反应的还原剂与还原产物物质的量之比来解答,还原产物是元素化合价降低做氧化剂被还原生成;
(3)As2S3与足量浓硝酸发生反应,当生成48g S,物质的量=$\frac{48g}{32g/mol}$=1.5mol,反应的As2S3的物质的量为0.5mol,生成标准状况下NO2的体积为112L,物质的量为$\frac{112L}{22.4L/mol}$=5mol,S元素化合价由-2价升高到0价,0.5molAs2S3反应电子转移0.5mol×[0-(-2)]×3=3mol,HNO3做氧化剂,生成二氧化氮5mol,电子转移为5mol×(5-4)=5mol,则根据电子守恒,设As失电子元素化合价变化为x,3+0.5mol×2(x-3)=5mol,x=5,生成产物为H3AsO4,1molAs2S3+
和10molHNO3发生氧化还原反应,结合原子守恒配平书写化学方程式;
(4)雄黄在空气中加热至300℃时会 两种氧化物,其中之一一种氧化物为剧毒的砒霜(As2O3),依据原子守恒可知另一种氧化物为二氧化硫,过氧化氢中氢元素化合价-1价变化为-2价,As元素化合价+3价变化为+5价,结合电子守恒和原子守恒写出该反应的化学方程式;
解答 解:(1)①硫元素是16号元素,原子核外有三个电子层,最外层6个电子,位于周期表中的第三周期,第ⅥA族,
故答案为:三;ⅥA;
②硫元素最高价为+6价,最高价氧化物对应的水化物为硫酸,化学式为H2SO4,
故答案为:H2SO4;
③Na3AsO4溶液与Zn反应生成AsH3,As元素化合价最高价+5价变化为-3价,化合价降低Na3AsO4做氧化剂,锌做还原剂;
故答案为:a;
(2)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,则反应为2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S,
根据电子得失守恒知2molAs2S3作氧化剂被还原得到4mol电子,生成1molAs4S4,而2molSnCl2作还原剂失去4mol电子得到氧化产物2molSnCl4,则还原剂与还原产物的物质的量之比为2:1,
故答案为:2:1;
(3)As2S3与足量浓硝酸发生反应,当生成48g S,物质的量=$\frac{48g}{32g/mol}$=1.5mol,反应的As2S3的物质的量为0.5mol,生成标准状况下NO2的体积为112L,物质的量为$\frac{112L}{22.4L/mol}$=5mol,S元素化合价由-2价升高到0价,0.5molAs2S3反应电子转移0.5mol×[0-(-2)]×3=3mol,HNO3做氧化剂,生成二氧化氮5mol,电子转移为5mol×(5-4)=5mol,则根据电子守恒,设As失电子元素化合价变化为x,3+0.5mol×2(x-3)=5mol,x=5,生成产物为H3AsO4,1molAs2S3+
和10molHNO3发生氧化还原反应,反应的化学方程式为:As2S3+10HNO3=2H3AsO4+3S+10NO2↑+2H2O,As元素化合价由+3价升高到+5价,S元素化合价由-2价升高到0价,则生成2mol H3AsO4,转移电子为2×2mol+3×2mol=10mol,
故答案为:+5,As2S3+10HNO3=2H3AsO4+3S+10NO2↑+2H2O;
(4)雄黄在空气中加热至300℃时会 两种氧化物,其中之一一种氧化物为剧毒的砒霜(As2O3),依据原子守恒可知反应为:As4S4+7O2$\frac{\underline{\;300℃\;}}{\;}$2As2O3+4SO2,另一种氧化物为二氧化硫,双氧水将As2O3氧化为H3AsO4而除去,氧化还原反应中过氧化氢中氢元素化合价-1价变化为-2价,As元素化合价+3价变化为+5价,结合电子守恒和原子守恒写出该反应的化学方程式:2H2O2+H2O+As2O3=2H3AsO4,
故答案为:SO2,2H2O2+H2O+As2O3=2H3AsO4;
点评 本题考查了信息分析,物质性质的应用,主要是氧化还原反应电子转移、电子守恒、化学方程式书写、错误判断,注意氧化还原反应概念和电子转移守恒的应用,题目难度中等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题
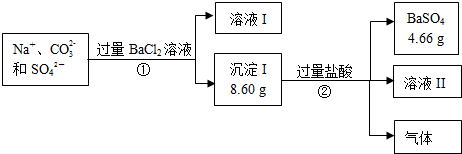
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| B. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 碳酸氢钙与少量澄清石灰水反应:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| D. | 强碱溶液中,次氯酸钠与Fe(OH)2:3ClO-+2Fe(OH)2═2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠保存在石蜡油或煤油中 | |
| B. | 实验室盛装NaOH溶液的试剂瓶用玻璃塞 | |
| C. | 保存FeSO4溶液需加入少量铁粉 | |
| D. | 氯水保存在棕色试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4HCN(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn(CN)2+(CN)2↑+2H2O | |
| B. | (CN)2+H2O═2H++CN-+CNO- | |
| C. | (CN)2+2OH-═CN-+CNO-+H2O | |
| D. | (CN)2+2SCN-═2CN-+(SCN)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
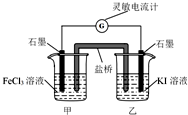
| A. | 反应开始时,乙中石墨电极上发生氧化反应 | |
| B. | 反应开始时,甲中石墨电极为正极 | |
| C. | 电流计读数为零时,反应达到化学平衡状态 | |
| D. | 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 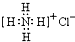 :可以表示氯化铵的电子式 :可以表示氯化铵的电子式 | |
| B. |  :可以表示中子数为18的氯原子结构示意图 :可以表示中子数为18的氯原子结构示意图 | |
| C. | 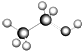 :可以表示乙醇分子的球棍模型 :可以表示乙醇分子的球棍模型 | |
| D. |  :既可以表示甲烷分子,也可以表示四氯化碳分子 :既可以表示甲烷分子,也可以表示四氯化碳分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 动物皮革的主要成分是蛋白质 | |
| B. | 天然蛋白质水解的最终产物是α氨基酸 | |
| C. | 皮革鞣制过程中使用的浓HNO3会使蛋白质盐析 | |
| D. | “皮革奶”灼烧时有烧焦羽毛的气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯元素的近似相对原子质量为35 | B. | 氯元素的某种同位素的质量数为35 | ||
| C. | 氯元素的中子数为18 | D. | 氯原子的质量为34.969 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com