
 X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.
X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.分析 X、Y、Z、W、R均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,即核外电子数为7,则X为N元素;W3+的基态离子3d轨道为半充满状态,离子核外电子排布为1s22s22p63s23p63d5,则W原子核外电子数为23+3=26,故W为Fe;R的氢氧化物悬浊液可用于检验葡萄糖的存在,则R为Cu;Y原子最外层有2对成对电子,外围电子排布为ns2np4,处于ⅥA族,Z的原子序数为Y的原子序数的2倍,结合原子序数可知,Y为O元素、Z为S元素,以此解答该题.
解答 解:X、Y、Z、W、R均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,即核外电子数为7,则X为N元素;W3+的基态离子3d轨道为半充满状态,离子核外电子排布为1s22s22p63s23p63d5,则W原子核外电子数为23+3=26,故W为Fe;R的氢氧化物悬浊液可用于检验葡萄糖的存在,则R为Cu;Y原子最外层有2对成对电子,外围电子排布为ns2np4,处于ⅥA族,Z的原子序数为Y的原子序数的2倍,结合原子序数可知,Y为O元素、Z为S元素,
(1)N2分子结构式为N≡N,分子中σ键和π键数目比=1:2,故答案为:1:2;
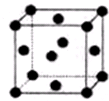
(2)R原子处于晶胞的面心及顶角,该晶胞中所含的原子个数=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,故答案为:4;
(3)①X为N元素,其第一电离能在同族元素中最大,故①错误;
②氧元素的氢化物为水或过氧化氢,常温下,分子间存在氢键,故②正确;
③NO3-中N原子价层电子对数=3+$\frac{5+1-2×3}{2}$=3,N原子的杂化轨道类型为sp2杂化,故③错误;
④W为Fe,外围电子排布为3d64s2,属于d区的元素,故④正确,
故答案为:②④;
(4)氨水滴入氢氧化铜悬浊液中,可得深蓝色溶液,该反应的离子方程是Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O;
(5)将Na2O2与Fe2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,该反应的离子方程式是4Na2O2+Fe2++6H2O=4Fe(OH)3↓+O2↑+8Na+,
故答案为:4Na2O2+Fe2++6H2O=4Fe(OH)3↓+O2↑+8Na+;
(6)X为N元素,N3-含有3个原子,电子数为22,互为等电子体的分子有N2O或CO2或CS2或BeCl2、离子有 SCN-或OCN-或CNO-,
故答案为:N2O或CO2或CS2或BeCl2; SCN-或OCN-或CNO-.
点评 本题考查结构性质位置关系综合应用,为高考常见题型,侧重于学生的分析能力的考查,涉及化学键、晶胞计算、电离能、杂化轨道、配合物、离子方程式等,推断元素是解题关键,(5)中离子方程式书写,可以先分步书写后再利用方程式加合得到,难度中等.


科目:高中化学 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能kJ•mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;E的离子结构示意图
;E的离子结构示意图 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2和 SO2 | B. | CO2和 H2O | C. | NaCl 和 HCl | D. | CCl4和 KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | LiH是离子晶体 | B. | LiH的水溶液呈酸性 | ||
| C. | LiH是一种氧化剂 | D. | LiH中H-半径大于Li+半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
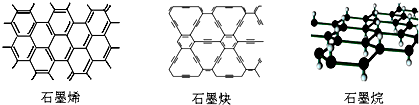
| A. | 石墨烯和石墨炔互为同素异形体 | |
| B. | 石墨炔有望替代二氧化硅用作半导体材料 | |
| C. | 12g石墨烯完全转变为石墨烷需标况下11.2L氢气 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
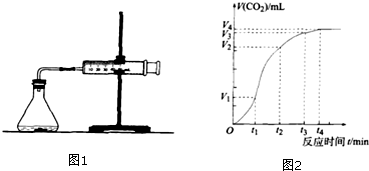
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
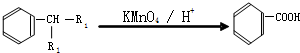
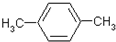 .
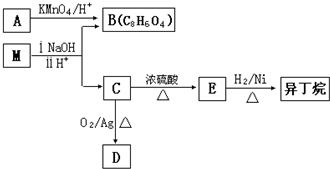
.
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 mol Fe与足量稀HNO3反应,转移电子的数目为2 NA | |
| B. | 18 g D2O中含有的质子数目为10 NA | |
| C. | 标准状况下,22.4 L二氯甲烷的分子数约为NA | |
| D. | 28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com