
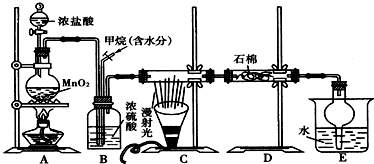
分析 (1)MnO2能将HCl(浓)氧化为MnCl2和Cl2;
(2)浓硫酸可以干燥氯气和氯化氢;
(3)甲烷可以和氯气发生取代反应,产物为氯化氢和二氯甲烷、三氯甲烷和四氯化碳;
(4)装置中最后剩余的氯化氢气体需要吸收不能排放到空气中;
(5)甲烷可以和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离;一氯甲烷是气体,还可能有过量的甲烷.
解答 解:(1)MnO2能将HCl(浓)氧化为MnCl2和Cl2,A装置所发生的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)生成的氯气中含有水,B装置除具有控制气流速度、均匀混合气体之外,因浓硫酸具有吸水性,还具有干燥作用,
故答案为:干燥混合气体;
(3)氯气与甲烷发生取代反应,反应特点是1mol氯气可取代1molH原子生成1molHCl,设$\frac{v(C{l}_{2})}{v(C{H}_{4})}$=x,若理论上欲获得最多的氯化氢,则x值应保证甲烷中H被完全取代,x≥4,故答案为:≥4;
(4)装置中最后剩余的氯化氢气体需要吸收不能排放到空气中,氯化氢易溶于水需要防止倒吸,E装置在吸收氯化氢时可防止倒吸,
故答案为:C;
(5)甲烷可以和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;其中一氯甲烷为气态,反应生成的二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开;
一氯甲烷是气体,还可能有过量的甲烷,所以尾气的主要成分是可能存在剩余的甲烷和生成的一氯甲烷等气体,应进行尾气处理,
故答案为:分液;ab.
点评 本题考查氯气的制备以及甲烷与氯气的取代反应,掌握反应的原理、准确把握产物的判断是答题的关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 氨水与醋酸的反应:NH3•H2O+CH3COOH=CH3COO-+NH4 ++H2O | |
| B. | 大理石与盐酸溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | H2SO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:H++SO42-+OH-+Ba2+=BaSO4↓+H2O | |
| D. | 铁屑溶于稀盐酸中:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
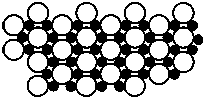 2001年3月发现硼化镁在39K时呈超导性,可 能是人类对超导认识的新里程碑.在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,如图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上.根据下图确定硼化镁的化学式为( )
2001年3月发现硼化镁在39K时呈超导性,可 能是人类对超导认识的新里程碑.在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,如图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上.根据下图确定硼化镁的化学式为( )| A. | MgB | B. | MgB2 | C. | Mg2B | D. | MgB6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)反应A+3B?2C+2D在四种不同情况下的反应速率分别如下:
(1)反应A+3B?2C+2D在四种不同情况下的反应速率分别如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
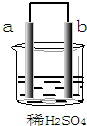
| A. | b极上发生了还原反应 | |
| B. | a是正极,b是负极 | |
| C. | a极上放出气体,溶液的pH增大 | |
| D. | 导线中有电子流动,电子从b极流到a极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com