
【题目】有A、B、C、D、E五种前四周期元素,原子序数依次增大。A为自然界中形成化合物种类最多的元素;C为地壳中含量最多的元素;D与A为同主族元素,且原子的质子数相差8;E是日常生活中用途最广、用量最大的金属元素。请回答下列问题:
(1)A的一种同位素具有放射性,在考古学上常用来测定文物的历史年代,写出该核素的符号:___。
(2)B的简单气态氢化物的电子式为___,若用玻璃棒蘸取浓盐酸靠近盛满该气体的集气瓶瓶口,则观察到的现象为___。
(3)C元素有16C、17C、18C三种核素,这三种核素的质子数之和为__。
(4)D元素在元素周期表中的位置为__,写出工业上制备含少量杂质的D单质的化学方程式: ___。
(5)写出少量E的单质与B的最高价氧化物对应的水化物的稀溶液反应的离子方程式:__。
【答案】![]() C或14C
C或14C ![]() 产生白烟 24 第三周期第IVA族 SiO2+2C
产生白烟 24 第三周期第IVA族 SiO2+2C![]() Si+2CO↑ Fe+4H++
Si+2CO↑ Fe+4H++![]() =Fe3++NO↑+2H2O
=Fe3++NO↑+2H2O
【解析】
根据题目已知条件,A为自然界中形成化合物种类最多的元素,则A为C元素;C为地壳中含量最多的元素,作为C为O元素;D与A为同主族元素,且原子的质子数相差8,则D为Si元素;E是日常生活中用途最广、用量最大的金属元素,则E为Fe元素;A、B、C、D、E五种元素,原子序数依次增大,B为N元素,据此分析。
(1)A的一种同位素具有放射性,在考古学上常用来测定文物的历史年代,则这种同位素为14C或![]() ;
;
(2)B的简单氢化物为NH3,其电子式为![]() ;若用玻璃棒蘸取浓盐酸靠近盛满该气体的集气瓶瓶口,二者发生反应生成NH4Cl,现象为产生白烟;
;若用玻璃棒蘸取浓盐酸靠近盛满该气体的集气瓶瓶口,二者发生反应生成NH4Cl,现象为产生白烟;
(3)O元素的三种不同的核素中质子数相同而中子数不同,故三种核素的质子数和为3×8=24;
(4)D元素为Si元素,在元素周期表中的位置为第三周期第ⅣA族;工业上制备含少量杂质的Si单质的化学方程式为SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(5)B的最高价氧化物对应的水化物为硝酸,稀硝酸与Fe反应的离子方程式为Fe+4H++![]() =Fe3++NO↑+2H2O
=Fe3++NO↑+2H2O


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期五种元素A、B、C、D、E的原子序数依次增大。A、B、C的单质在常温下都呈气态,C原子最外层电子数是电子层数的3倍,C和E位于同主族。1molDAx与足量的A2C反应生成44.8L(标准状况)G气体。A、B的单质依次为G、T,在密闭容器中充入一定量的G、T,一定条件下发生反应G+T![]() W(未配平),测得各物质的浓度如表所示。
W(未配平),测得各物质的浓度如表所示。
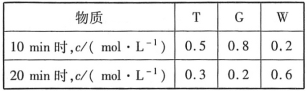
回答下列问题:
(1)A、B、C能组成既含离子键又含共价键的化合物,则该化合物的化学式为___。
(2)B、C、D、E的简单离子中,离子半径大小排序为___。(用具体的离子表示)
(3)J、L是由A、B、C、E四种元素组成的两种化合物,J、L溶液混合可产生有刺激性气味的气体,写出这两种溶液发生反应的离子方程式:___;J、L中能使酸性高锰酸钾溶液褪色的是___(填化学式)。
(4)B2A4—C2碱性燃料电池放电效率高。该电池放电时,负极反应式为___;正极附近溶液的pH___(填“增大”“减小”或“不变”)。
(5)由上述五种元素中的四种组成的单质、化合物在一定条件下的转化关系(部分条件和产物已省略)如图所示:
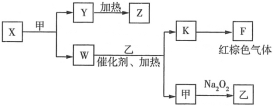
①Y是___(填化学式);W的电子式为___。
②B的最高价氧化物对应的水化物为Q,X与足量的Q溶液反应的化学方程式为___。
③1molW与足量乙完全反应生成K和甲,转移的电子数约为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、CO与Fe+体系中存在如图甲、乙所示的物质转变和能量关系。

下列说法错误的是( )
A.由图甲可知,反应过程中存在ΔH=ΔH1+ΔH2+ΔH3
B.Fe+在反应中作催化剂,能降低反应的活化能
C.若已知ΔH与ΔH3均小于0,则可知ΔH1与ΔH2也均小于0
D.由图乙可知,反应Fe+(s)+N2O(g)=FeO+(s)+N2(g)的ΔH4<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验过程证明了海带中存在的碘元素:
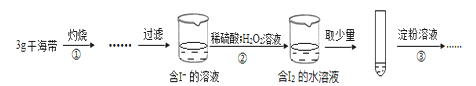
下列说法不正确的是
A.步骤①需要将干海带放入坩埚中灼烧
B.步骤②反应的离子方程式为:2I- +2H++H2O2=I2+2H2O
C.步骤③操作后,观察到试管中溶液变为蓝色,可以说明海带中含有碘元素
D.若步骤②仅滴加稀硫酸后放置一会儿,步骤③操作后,试管中溶液不变成蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用如图所示装置进行实验,探究铁和浓硫酸反应的产物及性质。(夹持装置已略,气密性已检验)
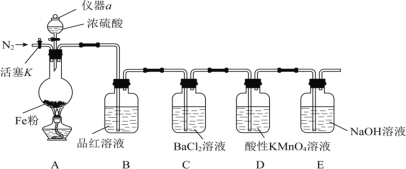
实验开始前,先打开活塞K通一段时间N2。关闭活塞K后,向A中滴加一定量的浓硫酸,加热观察到A中铁片上有气泡产生。
请回答下列问题:
(1)仪器a的名称是___。实验开始前,先通一段时间N2的目的是___。
(2)加热一段时间后发现B装置中溶液褪色,说明有__(填化学式)生成。再取出A中反应后的溶液少许,加入KSCN溶液未出现血红色,浓硫酸与铁反应的化学方程式是__。
(3)C装置中__(填“有”或“无”)沉淀生成。D装置中溶液紫色褪去,该反应的离子方程式为__。
(4)E装置的作用是__。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程,请回答下列问题:
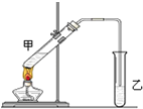
(1)浓硫酸的作用是:①__________②______________;
(2)饱和碳酸钠溶液的主要作用是________________;
(3)装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的____,长导管的作用是____;
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是____;
(5)进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是____;
(6)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是____;
(7)生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态,下列描述能说明该反应已达到化学平衡状态的是(填序号)____。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是合成二氢荆芥内酯的重要原料,其结构简式如下图,下列检验A中官能团的试剂和顺序正确的是( )
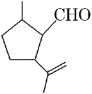
A. 先加酸性高锰酸钾溶液,后加银氨溶液,微热
B. 先加溴水,后加酸性高锰酸钾溶液
C. 先加银氨溶液,微热,再加入溴水
D. 先加入新制氢氧化铜,微热,酸化后再加溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中还原剂是___________________(填化学式),被2 mol FeSO4还原的过氧化钠为_________mol
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:__________________________
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是____________,被氧化的离子的物质的量分别是_____________________________________________
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+被氧化时,c为_____________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是
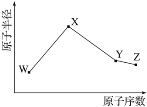
A.对应简单离子半径:X<W
B.对应简单气态氢化物的稳定性:Y<Z
C.化合物XZW既含离子键也含共价键
D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com