
100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度(设体积为二者之和)为
A.0.2 mol·L-1 B.0.25 mol·L-1 C.0.4 mol·L-1 D.0.5 mol·L-1
科目:高中化学 来源: 题型:
“哥伦比亚号”航天飞机的失事原因之一是覆盖在航天飞机外层的一片微不足道的隔热瓦脱离,引起飞机外表金属温度迅速升高而熔化解体。
其中照片显示,在“哥伦比亚号”机翼下方有几片小瓷片脱落,引起了科学家的注意,这是一种覆盖在航天飞机表面的特殊的陶瓷片,其主要作用是________。
A.增加航天飞机的强度,防止流星和太空垃圾撞击而损坏航天飞机
B.将太阳能转化为电能供航天飞机使用
C.便于雷达跟踪,接受地面指挥中心的指令
D.在返回大气层时,陶瓷耐高温隔热,有效地保护航天飞机平安返回地面
(2)隔热瓦是一种金属陶瓷,金属陶瓷是由陶瓷和黏结金属组成的非匀质的复合材料。下列关于复合材料的说法不正确的是________。
A.由两种或两种以上金属(或金属与非金属)熔合而成的物质叫复合材料
B.复合材料一般具有强度高、质量轻、耐高温、耐腐蚀等优异功能,在综合性能上超过了单一材料
C.玻璃钢是以玻璃纤维和树脂组成的复合材料,它可做船体,汽车车身等,也可做印刷电路板
D.复合材料的熔、沸点一般比它的各组成成分的熔、沸点低
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数,下列说法正确的是( )
A.常温常压下,2克氢气所含原子数目为NA
B.4.6克钠与水反应时失去的电子数目为0.2NA
C.在标准状况下,22.4LNH3所含的质子数目为NA
D.1 L0.5mol•L-1Na2SO4溶液中所含有的Na+离子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学实验兴趣小组欲采用如图所示的实验装置制
Cl2,同时进行与氯气有关的某些实验,按要求回答问题。
(1) 药品A的名称是 ,此反应的离子方程
式是 。
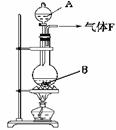 (2)甲同学用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下) 1.12 L(填“大于”“等于”“ 小于”)。
(2)甲同学用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下) 1.12 L(填“大于”“等于”“ 小于”)。
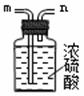
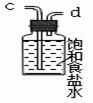
(3)在实验室中,乙同学欲用下图中的装置净化氯气,则气流方向是:
气体F→ → → → (填代号)。
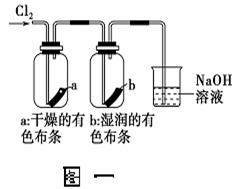
(4)把净化后的氯气通入如下(图一)装置。① 观察到a不褪色,b褪色, 可
得到的结论是: ;② 检验吸收Cl2后的NaOH溶液中含有Cl-时,需要滴加的试剂以及现象为 。
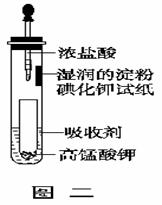
(5)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如上图二)。能说明Cl2的氧化性强于I2的实验现象是 : 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下①6.72L CH4 ②3.01×1023个HCl分子③13.6g H2S④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是 (多选一个倒扣一分)
a.体积②>③>④>① b.密度②>③>④>①
c.质量②>③>④>① d.氢原子个数①>③>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法不正确的是( )
A.常温下,22.4 L CO完全燃烧后生成CO2的分子数为NA
B.18 g水中含有的电子数为10NA
C.在1 L 2 mol·L-1的硝酸钙溶液中含有的NO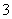 离子数为4NA
离子数为4NA
D.标准状况下,27 g金属铝与足量的稀硫酸反应,生成H2的体积约为33.6 L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤除去HCl气体中的Cl2可将气体通入饱和食盐水
A.①②③ B.②③④ C.③ D.③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com