
| A. | X2Y3 | B. | X3Y2 | C. | Y2X3 | D. | Y3X2 |
科目:高中化学 来源: 题型:解答题
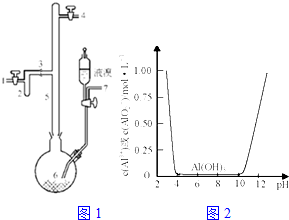 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
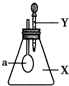 如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来.气体X和液体Y不可能是( )
如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压胶头滴管,使液体Y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来.气体X和液体Y不可能是( )| X | Y | |
| A | NH3 | H2O |
| B | SO2 | NaOH溶液 |
| C | CO2 | 6mol•L-1 H2SO4溶液 |
| D | HCl | 6mol•L-1 Na2SO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2═P4O6的反应热△H为( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2═P4O6的反应热△H为( )| A. | -1 638 kJ/mol | B. | +1 638 kJ/mol | C. | -126 kJ/mol | D. | +126 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | (1) | (2) | ||||||
| 三 | (3) | (4) | (5) | (6) | (7) | (8) | (9) | |
| 四 | (10) | (11) | (12) |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

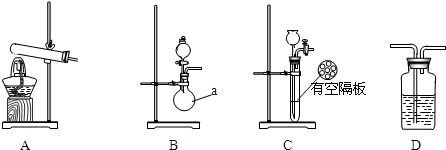
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为① (NH4)2SO4+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaSO4. |
| 乙小组 | ②B | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③氢氧化钠溶于氨水后放热,增加氢氧根浓度,使NH3+H2O?NH3•H2O?NH4++OH-向逆反应方向移动,加快氨气逸出. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无论是纯水还是酸性、碱性或中性稀溶液,常温下,其c(H+)•c(OH-)=1×10-14 | |
| B. | 某溶液由水电离出的c(OH-)=10-a mol/L,若a>7时,则该溶液的pH一定为14-a | |
| C. | 0.2 mol/L CH3COOH溶液中的c(H+)是0.1 mol•L-1 CH3COOH溶液中的c(H+)的2倍 | |
| D. | 任何浓度的溶液都可以用pH来表示其酸性的强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com