
| 选项 | 化学反应及 离子方程式 | 评 价 |
| A | 醋酸钠溶于水:CH3COO-+H2O═CH3COOH+OH- | 正确 |
| B | 实验室用浓盐酸与MnO2反应制Cl2: MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O | 错误,反应物中HCl电离出的H+、Cl-比例为1:1 |
| C | 硝酸铁溶液中加过量氨水:Fe3++3NH3•H2O═Fe(OH)3(胶体)+3NH4+ | 错误,Fe(OH)3应该是沉淀 |
| D | 铝溶于碳酸中:2Al+3H2CO3═2Al3++3H2+3 CO32- | 正确 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.水解为可逆反应;
B.离子反应正确;
C.反应生成沉淀,而不是胶体;
D.生成氢氧化铝和氢气.
解答 解:A.水解反应是可逆反应,醋酸钠溶于水的离子反应为CH3COO-+H2O?CH3COOH+OH-,故A错误;
B.离子方程式是正确的,多余的2个Cl-在溶液中没参加化学反应,故B错误;
C.硝酸铁溶液中加过量氨水的离子反应为Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+,故C错误;
D.铝与碳酸会有所反应,反应分为两步.碳酸是CO2的水溶液,里面有H+、OH-、CO3 2-、HCO3-、H2O、H2CO3、CO2这几种离子和物质,当Al投入的时候,会与水发生反应,产生Al(OH)3,如果只是纯粹水溶液的话由于反映产生的Al(OH)3是一层质密的薄膜,将Al与水阻挡开,使反应停止.但是水溶液里面还有大量酸性的H+、HCO3-离子,会与Al(OH)3反应,使反应继续下去,最终反应能够得到Al3+离子的,其实反应的实质就是2Al+6H2O=2Al(OH)3+3H2,而中间借助了酸溶液的酸性,使反应不断进行,最后得到Al3+,但是水解又会得到Al(OH)3,Al3++3H2O=Al(OH)3+3H+,而酸是弱酸,双水解情况下,不存在Al2(CO3)3,所以最后就是得到Al(OH)3,反应现象是冒气泡和生成沉淀,总之:碳酸铝是不存在的,或者说是极其不稳定,只有在少数高端实验室条件下才可以实现.而单质铝投入碳酸水中是会反应的,实验现象是生成沉淀和冒气泡,沉淀是氢氧化铝,故D错误;
故选C.
点评 本题考查离子方程式正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、水解反应的离子反应考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑤ | C. | ③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
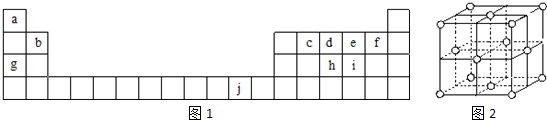
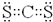 ,ci2与ce2比较,沸点较高的是CS2(写分子式).
,ci2与ce2比较,沸点较高的是CS2(写分子式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
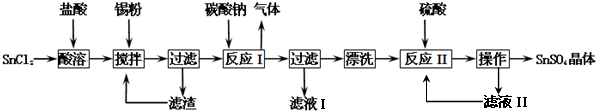
| HCl气体体积/(m3.L-1) | 结晶效率/% | HCl利用效率/% |
| 0.0375 | 11.8 | 93.2 |
| 0.075 | 31.5 | 89.8 |
| 0.1225 | 59.0 | 83.2 |
| 0.15 | 68.0 | 74.9 |
| 0.1875 | 71.0 | 67.8 |
| 0.225 | 73.1 | 59.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V (NaOH)始/mL | 0.00 | 0.20 | 0.10 | 0.10 |
| V (NaOH)终/mL | 14.98 | 15.20 | 15.12 | 16.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com