
| A. | 形成原电池时,铝作阴极极 | |
| B. | 形成原电池时,铜作负极 | |
| C. | 形成原电池时,电流由铝经导线流向铜 | |
| D. | 铝铆钉发生了电化学腐蚀 |
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的消去反应可用水浴加热 | |
| B. | 检验无水乙醇中是否含有少量水:加硫酸铜晶体观察现象 | |
| C. | 区别苯和乙苯:加酸性高锰酸钾溶液,振荡,观察现象 | |
| D. | 检验氯代烃中的氯元素时,可先加入硝酸溶液,再加入硝酸银溶液来进行检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据反应:Zn+CuSO4=ZnSO4+Cu,选择适宜的材料和试剂设计一个原电池,完成下列问题:
根据反应:Zn+CuSO4=ZnSO4+Cu,选择适宜的材料和试剂设计一个原电池,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
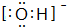 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
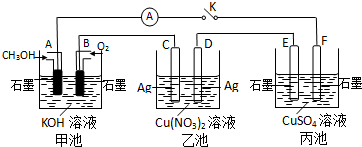
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol 的2H35Cl分子中的中子数是2NA | |
| B. | 1 mol乙醇所含的羟基的电子数是9NA | |
| C. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| D. | 将2.24 L(标准状况下)CO2通入1 L 0.15 mol•L-1的NaOH溶液中,所得CO32-和HCO3-物质的量均为0.05mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com