
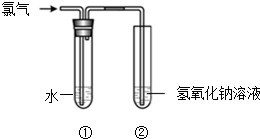
 某同学用图所示装置制取氯水并进行相关实验.
某同学用图所示装置制取氯水并进行相关实验.分析 (1)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(2)氯气呈黄绿色;
(3)蓝色石蕊遇酸变红色,次氯酸具有漂白性;
(4)根据氧化还原反应的特征,氯的化合价有升高也有降低,Cl2→NaClO3氯的化合价升高,而A中氯的化合价比0价低,所以A中的氯是-1价.
解答 解:(1)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(2)只有氯气呈黄绿色,其它物质都呈无色,所以含有Cl2,故答案为:Cl2;
(3)蓝色石蕊遇酸变红色,次氯酸具有漂白性,取少量装置①中的溶液滴在蓝色石蕊试纸上,试纸先变红后褪色,说明氯水具有酸性和漂白性,故选a;
(4)根据氧化还原反应的特征,氯的化合价有升高也有降低,Cl2→NaClO3氯的化合价升高,而A中氯的化合价比0价低,所以A中的氯是-1价,所以A是NaCl,故答案为:NaCl.
点评 本题考查了氯气的有关性质,知道氯水中的成分及各种成分的性质是解本题关键,知道非金属性强弱的判断方法有哪些,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 流出溶液的体积为(m-n) mL | B. | 流出溶液的体积为(n-m) mL | ||
| C. | 管内溶液体积等于(a-n) mL | D. | 管内溶液体积多于n mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲烧杯中溶液浓度为0.1 mol•L-1,则乙烧杯中溶液浓度大于0.01 mol•L-1 | |
| B. | 向甲烧杯中加入等体积pH=(14-a)的NaOH溶液后,溶液显碱性 | |
| C. | 两溶液中水电离出的OH-浓度:10C甲(OH-)<C乙(OH-) | |
| D. | 取等体积甲乙溶液分别与适量NaOH溶液完全中和,所得溶液的pH:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应 | |
| C. | 氯气具有漂白性 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数大于4的元素不一定是非金属元素 | |
| B. | 同周期的主族元素从左到右,非金属性逐渐增强,气态氢化物稳定性逐渐减弱 | |
| C. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素不一定是金属元素 | |
| D. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向100mL0.1mol•L-1的Na2CO3溶液中滴加含0.01molCH3COOH的醋酸溶液CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 4mol•L-1的NaAlO2溶液和7mol•L-1的盐酸等体积均匀混合4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 等物质的量的FeBr2与Cl2反应(已知:Br2+2Fe2+═2Fe3++2 Br-,Cl2+2Br-═Br2+2Cl-):2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 向NaAlO2溶液中通入过量CO2的反应:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 取6根铁钉、6支洁净试管及其他材料,按图所示准备.
取6根铁钉、6支洁净试管及其他材料,按图所示准备.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com