
| A. | 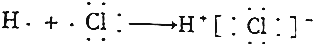 | |
| B. | 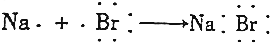 | |
| C. | 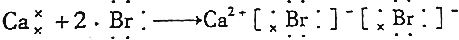 | |
| D. | 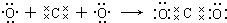 |
分析 A.HCl属于共价化合物;
B.NaBr属于离子化合物;
C.溴化钙电子式为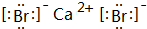 ;
;
D.二氧化碳属于共价化合物,分子中碳原子与每个氧原子之间形成2对共用电子对.
解答 解:A.HCl属于共价化合物,用电子式表示HCl形成过程为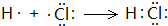 ,故A错误;
,故A错误;
B.NaBr属于离子化合物,用电子式表示NaBr形成过程为: ,故B错误;
,故B错误;
C.溴化钙电子式为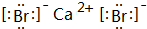 ,用电子式表示其形成过程为
,用电子式表示其形成过程为 ,故C错误;
,故C错误;
D.二氧化碳属于共价化合物,分子中碳原子与每个氧原子之间形成2对共用电子对,用电子式表示形成过程为: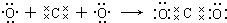 ,故D正确,
,故D正确,
故选:D.
点评 本题考查用电子式表示物质或化学键形成,左边为原子电子式,右边为物质的电子式,中间用箭头连接,熟练掌握常见微粒与化合物电子式的书写.


科目:高中化学 来源: 题型:选择题
| A. | Z的氢化物是同主族简单氢化物中沸点最低的一种 | |
| B. | 非金属性:Z>Y>X | |
| C. | XY2中各原子最外层均满足8电子结构 | |
| D. | X、Y、Z的氢化物中化学键均为极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时如果发现滤液是浑浊的,则滤液还要进行过滤 | |
| B. | 在进行蒸馏时,要加少量碎瓷片,防止液体暴沸 | |
| C. | 在进行分液操作时,分液漏斗内外气体相通,眼睛要注视烧杯中的溶液 | |
| D. | 在进行蒸馏时,温度计不要插入溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=5时,c(Na+)+c(H+)=c(OH-)+c(H2C2O4)+2c(C2O42-) | |
| B. | 当a=10时,c(Cl-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | 当a=15时,c(H2C2O4)+c(HC2O4-)=0.04mol•L-1 | |
| D. | 当a=20时,c(Na+)=c(H+)>c(HC2O4-)>c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
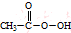 (过氧乙酸)+H2O
(过氧乙酸)+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室所制得的1.7gNH3中含有的电子数为0.1NA | |
| B. | 标准状况下2.24LHF中含有HF分子数为0.1NA | |
| C. | 1L0.1 mol•L-1NaHSO4溶液中含有的阳离子数目为0.1NA | |
| D. | 0.1mol氯酸钾与足量盐酸反应生成氯气转移电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题:
已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com