
1996年诺贝尔化学奖授予斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域.后来,人们又发现了一种含碳量极高的链式炔烃──棒碳,它是分子中含300~500个碳原子的新物质,其分子中只含有交替连接的单键和叁键.对于C60与棒碳,下列说法正确的是( )
|
| A. | C60与棒碳中所有的化学键都是非极性共价键 |
|
| B. | 棒碳不能使溴水褪色 |
|
| C. | C60在一定条件下可能与CuO发生置换反应 |
|
| D. | 棒碳与乙炔互为同系物 |
考点:
极性键和非极性键;芳香烃、烃基和同系物.
专题:
信息给予题.
分析:
A.同种非金属元素之间形成非极性共价键,不同非金属元素之间形成极性共价键;
B.叁键能与单质溴发生加成反应而使溴水褪色;
C.同素异形体的化学性质相似;
D.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物,需要注意的是官能团的种类和数目相同.
解答:
解:A.C60中所有的化学键都是碳元素和碳元素形成的非极性共价键,棒碳中既有碳元素和碳元素形成的非极性共价键,又有碳元素和氢元素形成的极性共价键,故A错误;
B.棒碳中含有的叁键能与单质溴发生加成反应而使溴水褪色,故B错误;
C.C在一定条件下与CuO发生置换反应,而同素异形体的化学性质相似,所以C60在一定条件下可能与CuO发生置换反应,故C正确;
D.棒碳中含有多个叁键,而乙炔中只有一个叁键,所以棒碳与乙炔不是同系物,故D错误;
故选:C.
点评:
本题主要考查了官能团的性质、同素异形体的性质,同系物的概念,难度不大,根据所学知识即可完成.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
下列各组比较中,前者比后者大的是( )
|
| A. | 25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度 |
|
| B. | 25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度 |
|
| C. | 同温度、同浓度的NaCl溶液和氨水的导电能力 |
|
| D. | 25℃时,pH均为3的HCl和FeCl3溶液中水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aX+2Y(g)⇌2Z(g)在一定条件下达到平衡后,t1和t2时各改变某一种外界条件,化学反应速率(v)﹣时间(t)图象如图.则下列说法正确的是( )
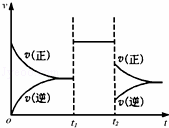
|
| A. | 若X是固体,则t1时一定是增大了容器的压强 |
|
| B. | 若X是气体,则t2时可能是增大了容器的压强 |
|
| C. | 若X是固体,则t1时可能是增大了X的质量 |
|
| D. | t2时不可能是减小容器压强;若采用了降温措施,则该反应的正反应方向△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
类推是学习和研究的重要思维方法.下列类推结论正确的是()
化学事实 类推结论
A Al在O2中燃烧生成Al2O3 Fe在O2中燃烧也生成Fe2O3
B pH=3的盐酸稀释1000倍后pH=6 pH=6的盐酸稀释1000倍后pH=9
C 用电解熔融MgCl2的方法冶炼金属镁 用电解熔融NaCl的方法制取金属钠
D 将SO2通入BaCl2溶液中无沉淀生成 将SO2通入Ba(NO3)2溶液中也无沉淀生成
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
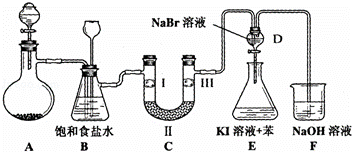
(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为: .
(2)装置B中饱和食盐水的作用是 ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入D.
A B C D
Ⅰ 干燥的有色布条 干燥的有色布条 湿润的有色布条 湿润的有色布条
Ⅱ 碱石灰 硅胶 浓硫酸 无水氯化钙
Ⅲ 湿润的有色布条 湿润的有色布条 干燥的有色布条 干燥的有色布条
(4)设计装置D、E的目的是 .打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是 .
(5)某同学建议将装置F中的药品改用足量的NaHSO3溶液吸收余氯,老师认为不妥,用总反应的离子方程式解释原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C都是有机化合物,且有如下转化关系:A B
B C,A的相对分子质量比B大2,C的相对分子量比B大16,C能与过量的NaOH反应生成一种常见的气体,以下说法正确的是( )
C,A的相对分子质量比B大2,C的相对分子量比B大16,C能与过量的NaOH反应生成一种常见的气体,以下说法正确的是( )
|
| A. | A是乙炔,B是乙烯 | B. | A是乙烯,B是乙烷 |
|
| C. | A是乙醇,B是乙醛 | D. | A是环己烷,B是苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下H2密度的12.5倍.该混合气体通过装有溴水的试剂瓶时,试剂瓶的质量增加了8.4g.该混合气体可能是( )
|
| A. | 乙烷和乙烯 | B. | 乙烷和丙烯 | C. | 甲烷和乙烯 | D. | 甲烷和丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
.根据下列化学实验示意图及表中实验现象,从理论上分析得出的结论正确的是( )
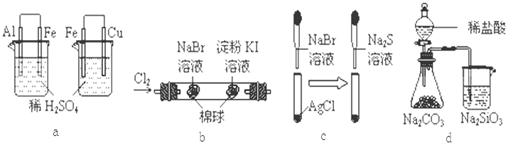
| 选项 | 实验 | 实验现象 | 结论 |
| A | a | 左烧杯铁表面有气泡,右烧杯铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | b | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | c | 白色固体先变为淡黄色,后变为黑色 | 溶解度:AgCl < AgBr <Ag2S |
| D | d | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
|
| A. | 常温常压下,1mol C2H4所含的电子数为12NA |
|
| B. | 标准状况下,16g甲烷中共价键数目为4NA |
|
| C. | 常温常压,4 g氦气所含的核外电子数为4NA |
|
| D. | 16g氧气和臭氧的混合物中含有1.5NA个氧原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com