
���û�ѧ��Ӧԭ���о�Ԫ�ؼ��仯����ķ�Ӧ����Ҫ���塣
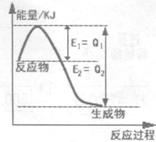
��1�����������У�SO2����������SO3��2SO2(g)�� O2(g) 2SO3(g)�������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺
2SO3(g)�������ϵ��SO3�İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺

��2SO2(g) + O2(g) 2SO3(g)�ġ�H____0(�>������<��)�����ں��¡���ѹ������������ƽ����ϵ��ͨ�뺤����ƽ�� �ƶ�����������ҡ����ƶ����� ��
2SO3(g)�ġ�H____0(�>������<��)�����ں��¡���ѹ������������ƽ����ϵ��ͨ�뺤����ƽ�� �ƶ�����������ҡ����ƶ����� ��
�����¶�ΪT1ʱ����Ӧ���е�״̬Dʱ��V��_______V�����>����<����=����
��2�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ����������Ҫ���á�
�� ��ͼ��һ�����¶Ⱥ�ѹǿ��N2��H2��Ӧ����lmolNH3�����������仯ʾ��ͼ����д����ҵ�ϳɰ����Ȼ�ѧ����ʽ������H�ú���ĸQ1��Q2�Ĵ���ʽ��ʾ�� ��
����AlCl3��Һ�еμӰ�ˮ����Ӧ�����ӷ���ʽΪ�� ��
��3����ˮ�к��д�����Ԫ�أ�����Ԫ�����ȡ���Ԫ������ں�ˮ�о��Ի���̬���ڡ���25���£���0.1mol•L��1��NaCl��Һ����μ���������0.1mol•L��1��������Һ���а�ɫ�������ɣ���Ӧ�����Һ�У���������0.1mol•L��1��NaI��Һ�������������� ȫƷ��ѧ���� �ú��벻�ˣ��������������ԭ���ǣ������ӷ���ʽ��ʾ���� ��
ȫƷ��ѧ���� �ú��벻�ˣ�����֪25��ʱKsp[AgCl] =1.0��10-10 mol2•L��2��Ksp[AgI] =1.5��10-16mol2•L��2 ��
��֪ʶ�㡿��ѧƽ���ƶ�ԭ�����Ȼ�ѧ����ʽ�������ܽ�ƽ��
���𰸽�������16�֣���1���٣���2�֣��� ����2�֣�������2�֣���2����N2(g) + 3H2(g) 2NH3(g) ��H��2(Q1-Q2) KJ/mol����3�֣���Al3+ +3NH3·H2O��Al(OH)3��+3NH4+ ��3�֣���3����ɫ����ת��Ϊ��ɫ������2�֣� AgCl(s)+I��(aq)��AgI(s)+Cl��(aq) ��2�֣�
2NH3(g) ��H��2(Q1-Q2) KJ/mol����3�֣���Al3+ +3NH3·H2O��Al(OH)3��+3NH4+ ��3�֣���3����ɫ����ת��Ϊ��ɫ������2�֣� AgCl(s)+I��(aq)��AgI(s)+Cl��(aq) ��2�֣�
��������1���ٸ���ͼʾ���¶����ߣ�SO3%��С��˵��ƽ�������ƶ������淴ӦΪ���ȷ�Ӧ������ӦΪ���ȷ�Ӧ����H��0���ں��¡���ѹ������������ƽ����ϵ��ͨ�뺤�����������������ƽ�������ƶ��������¶�ΪT1ʱ����Ӧ���е�״̬Dʱ����Ӧ������Ӧ������У���V����V������2���ٸ÷�ӦΪ���ȷ�Ӧ�����H��2(Q1��Q2) KJ/mol������AlCl3��Һ�еμӰ�ˮ��������ɫ���������������ܽ⣬���ӷ���ʽΪ��Al3+ +3NH3·H2O��Al(OH)3��+3NH4+����3����AgCl��Һ�м���NaI��Һ������������ת����AgCl(s) + I��(aq)��AgI(s) + Cl��(aq)��
��˼·�㲦�������ۺϿ��黯ѧ��Ӧԭ��������һ�����ۺ��ԣ��������ѶȲ�����ؼ�����ȷ���⻯ѧ��Ӧԭ����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��������ˮʱ��Һ�¶Ƚ��ͣ������ֽ���Ȼ�ѧ����ʽΪCuSO4•5H2O��s�� CuSO4��s��+5H2O��l����H=+Q1 kJ•mol��1�������£�����1mol��ˮ����ͭ�ܽ�Ϊ��Һʱ����Q2 kJ����Q1��Q2�Ĺ�ϵΪ��������
CuSO4��s��+5H2O��l����H=+Q1 kJ•mol��1�������£�����1mol��ˮ����ͭ�ܽ�Ϊ��Һʱ����Q2 kJ����Q1��Q2�Ĺ�ϵΪ��������
| �� | A�� | Q1��Q2 | B�� | Q1=Q2 | C�� | Q1��Q2 | D�� | ���Ƚ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʾ���ֱ����ܱ������ڿ��ƶ����������߳������(��֪�������ռ���������ݻ���1/4)��H2��O2�Ļ�����壬�ڱ�״̬�£�����H2��O2�Ļ�������ȼ���������������ָ�ԭ�¶Ⱥ����һ�ͣ�������������롣��ԭ��H2��O2�����֮�ȿ���Ϊ(����)
A��2��7 B��5��4 C��2��1 D��7��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
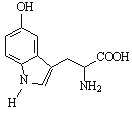
5����ɫ��������˯�߾��е������ã���ṹ��ʽ����ͼ��ʾ�������й�5����ɫ��˵����������
A�����л������ʽΪC11H12N2O3
B�����л������������ԭ�Ӳ����ܹ�ƽ��
C�������к���1������̼ԭ��
D��1mol������������4molH2��1molBr2������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������ͭ�̳������������ս�ȡ���ȿɱ��������ֿɵõ���;�㷺�ĸߴ�����п����֪�̳�����Ҫ��ZnO������������FeO��Fe2O3��CuO��MnO���Ʊ������������£�
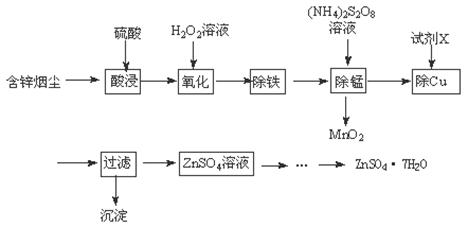
��1������п��Һ����ʯ����Һ����Һ��죬��ԭ���� ��
��2��H2O2����Fe2+�����ӷ���ʽΪ ��
��3����������ʱ����Һ��pHӦ������ ����ؽ������������������������pH��������ȫ��pH���±����������ӿ�ʼ����ʱ��Ũ��Ϊ1mol��L��1����
| �������� | ��ʼ������pH | ������ȫ��pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.5 | 8.0 |
| Cu2+ | 5.2 | 6.7 |
| Fe2+ | 5.8 | 8.8 |
��4�������̡�ʱ��Һ�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��5���Լ�XΪ ��
��6����ZnSO4��Һ�辭���� �� �����˼������ZnSO4��7H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���û�ѧ��Ӧԭ��֪ʶ�ش������й�̼��̼�Ļ���������⣺
(1)����β������Ҫ��Ⱦ����NO�Լ�ȼ��ȼ�ղ���ȫ��������CO���������ִ������е���Ҫ������Ⱦ�Ϊ�˼�������β����ɵĴ�����Ⱦ�����ǿ�ʼ̽������NO��CO��һ��������ת��Ϊ����������E��F�ķ���(��֪�÷�Ӧ��H<0). ��2 L�ܱ������м���һ����NO��CO�����¶ȷֱ���T1��T2ʱ����ø�����ƽ��ʱ���ʵ������±���
|
T/�� n/mol | NO | CO | E | F |
| ��ʼ | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
�������ϱ����ݣ�д��NO��CO��Ӧ�Ļ�ѧ����ʽ .
��������ӦT1��ʱ��ƽ�ⳣ��ΪK1��T2��ʱ��ƽ�ⳣ��ΪK2�����ݱ������ݼ���K1= �����ݱ��������жϣ��¶�T1��T2�Ĺ�ϵ��(�����)__________��
A��T1>T2B��T1<T2 C��T1=T2 D�����Ƚ�
(2)��Ӧ���ɵ�����E�������������������գ�����0.4molE������200mL 3mol/L NaOH��Һ������ȫ���գ���Һ������Ũ���ɴ�С��˳��Ϊ�� .
(3)��֪CH4��H2��CO��ȼ���ȷֱ�Ϊ890.3kJ/mol��285.8 kJ/mol��283.0 kJ/mol����ҵ��������Ȼ��(��Ҫ�ɷ���CH4)��CO2���и��������Ʊ�CO��H2��д���÷�Ӧ���Ȼ�ѧ����ʽ�� .
(4)CO����������ȼ�ϵ�ص�ȼ�ϣ�ij������ȼ�ϵ�ؾ��иߵķ���Ч�ʣ�����ܵ����ӣ��õ���� Li2CO3 �� Na2CO3 �������λ����������ʣ�COΪ����ȼ����������CO2 �Ļ����Ϊ������ȼ�����Ƶ��� 650 ���¹�����ȼ�ϵ�أ�д���为���������缫��Ӧ����ʽ�������� �������� .
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ŵ��������ѧ�����衰����֮����Ӣ�������ѧ�Ҹ���Լ���λ������ѧ��������·������������·ʷ��˹�����ά����Ҫ�ɷ��Ƕ������裬���й��ڶ��������˵����ȷ����(����)
A������������H2SiO3���������������ˮ��Ӧ
B���ö���������ȡ���ʹ�ʱ��������2.24 L(���)����ʱ���õ�2.8 g��
C��6 g�Ķ��������к���0.2 mol�Ĺ��ۼ�
D���������費����̼������Һ��Ӧ��������̼���ƹ����ڸ���ʱ������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ػ�ѧ֪ʶ���� �жϣ����н��۴������
�жϣ����н��۴������
A��ij���ȷ�Ӧ���Է����У���˸÷�Ӧ��������Ӧ
B��NH4Fˮ��Һ�к���HF�����NH4F��Һ���ܴ���ڲ����Լ�ƿ��
C����ȼ����Ҫ������ˮ�ڵ��¸�ѹ���γɵ�ˮ���ᄃ�壬��˿ɴ����ں���
D������Ӧ��Ũ�ȿɼӿ췴Ӧ���ʣ������Ũ����������Ӧ����������H2������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��̿��(SiO2·H2O)�㷺������Ϳ�ϡ�ӡˢ����ҵ����������ʯ[��Ҫ�ɷ�ΪMg6(Si4O10)(OH)8]����ȡ������Ҫ�����������£�

(1)����ʯ����������ʽ�ɱ�ʾΪ_____________________________��
(2)���ʱ��Ϊ������й����εĽ�ȡ�ʣ������ú��ʵ�Һ�̱Ⱥ�ѭ����ȡ�⣬���ɲ��õķ����Т�____________________����____________________(�ξ�����)��
(3)����1�õ�����Һ����Ҫ�ɷ���________��
(4)����ʱ�����Ȼ�����Һ�����ÿ�����__________________________��
(5)ϴ��ʱ����α�֤����Ʒ��ϴ�Ӹɾ���__________________________
________________________________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com