
(14分).A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的离子不含电子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)C元素在元素周期表中的位置是
(2)C和E两种元素相比较,非金属性较强的是(填元素名称) ,可以验证该结论的是(填写编号) ;
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(4)F含有的化学键类型是 ,其水溶液呈酸性,请用相关的离子方程式解释其原因
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
(14分)A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体。E、F、G、H、I为五种化合物,F不溶水,E为气体且极易溶水成为无色溶液,G溶水得黄棕色溶液。这九种物质间反应的转化关系如图所示
(1)写出四种单质的化学式
A____ _____ B__________ C__ ____ D___ _____
(2)写出E+F→H+I的离子方程式
(3)写出G+I→H+D+E的化学方程式
(4)某工厂用B制漂白粉。
①写出制漂白粉的化学方程式 。
②为测定该工厂制得的漂白粉中有效成分的含量,某该小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配置成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸(此时发生的离子方程式为: ),静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省高三第三次大考化学试卷 题型:实验题
(一)(14分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
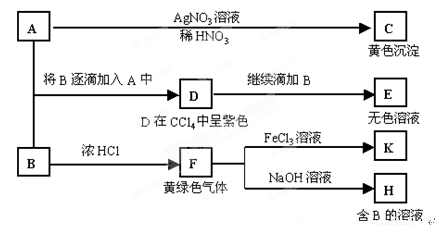
请回答:
(1)写出A、B和C的化学式:A ,B ,C 。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
, 。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
(4)写出由F→H的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年甘肃省高三第三次模拟考试(理综)化学部分 题型:填空题
(14分A、B、C、D 、E、F是常见的气体,其中A、B、C、D为单质,有关的转化关系如下图所示(反应条件均已略去)。

请回答下列问题:
(1)D的电子式为 。
(2)反应③的离子方程式为 。
(3)Y和E在一定条件下可反应生成B和Z,可消除E对环境的污染,该反应的化学方程式为 。
(4)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是 。
①该溶液的pH=11
②该溶液中的溶质电离出的阳离子浓度为0.1mol/L
③将pH=11的Y溶液加水稀释100倍后,pH值为9
④该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
⑤0.1mol/L的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
(5)常温下pH=a的X溶液和pH=b的Y溶液等体积混合,若a+b=14,则混合后的溶液呈________性,混合溶液中各离子浓度大小关系为______ ______________。
查看答案和解析>>
科目:高中化学 来源:2009-2010学年正定中学高二下学期期末考试化学 题型:填空题
(14分)A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体。E、F、G、H、I为五种化合物,F不溶水,E为气体且极易溶水成为无色溶液,G溶水得黄棕色溶液。这九种物质间反应的转化关系如图所示

(1)写出四种单质的化学式
A____ _____ B__________ C__ ____ D___ _____
(2)写出E+F→H+I的离子方程式
(3)写出G+I→H+D+E的化学方程式
(4)某工厂用B制漂白粉。
①写出制漂白粉的化学方程式 。
②为测定该工厂制得的漂白粉中有效成分的含量,某该小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配置成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸(此时发生的离子方程式为: ),静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com