
【题目】相同温度下,容积相同的3个恒温密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.6KJ·mol-1
2NH3(g) ΔH=-92.6KJ·mol-1
实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始各物质的物质的量/mol | 达平衡时体系能量的变化 | |||
N2 | H2 | NH3 | Ar | ||
① | 1 | 3 | 0 | 0 | 放出热量:Q1 |
② | 0.9 | 2.7 | 0.2 | 0 | 放出热量:Q2 |
③ | 0.9 | 2.7 | 0.2 | 0.1 | 放出热量:Q3 |
下列比较正确的是
A. 放出热量大小:Q1>Q2=Q3
B. 容器中的压强:③>①=②
C. N2的转化率:①<②<③
D. 平衡时NH3的体积分数:①=②<③
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知: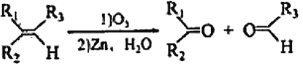 ,其中R1、R2、R3为烷基。现有一种五元环状内酯F的合成路线如下(C~G均表示一种有机化合物):
,其中R1、R2、R3为烷基。现有一种五元环状内酯F的合成路线如下(C~G均表示一种有机化合物):
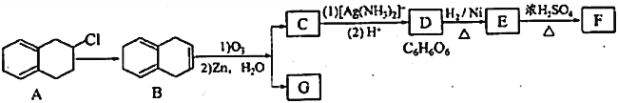
回答下列问题:
(1)化合物B的分子式为________,G中含有的官能团名称是_________________________________。
(2)由A→B所需的反应试剂和反应条件为___________________________。
(3)化合物E的系统命名为________________________________________。
(4)根据已知信息,由B生成C和G的的化学方程式为______________________________________。
(5)同时满足下列条件的G的同分异构体一共有____________________种(不含顺反异构)。
(I)与NaHCO3反应产生气体 (II)能使溴水褪色
(6)根据题给信息,写出用2,3—二甲基—2—丁烯制备丙烯的合成路线(其他试剂任选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强 ②混合气体的密度③混合气体的总物质的量 ④混合气体的平均相对分子质量 ⑤混合气体的颜色。
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是______(填序号,下同)。
2SO3(g)达到平衡状态的是______(填序号,下同)。
(2)一定能证明 A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是_______。(注:B,C,D均为无色物质)
C(g)+D(g)达到平衡状态的是_______。(注:B,C,D均为无色物质)
II.某温度时,在一个1L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(1)反应开始至2min,以气体Y表示的平均反应速率为________;
(2)该反应的化学方程式为___________;
(3)amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅲ.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图。则电池工作时负极的电极反应式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应:mA(g)+nB(g) ![]() pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.5倍,下列说法正确的是( )
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.5倍,下列说法正确的是( )
A. ![]() B. 平衡向逆反应方向移动
B. 平衡向逆反应方向移动
C. A的转化率减小 D. C的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液中可能有NO3﹣、Cl﹣、I﹣和Fe3﹢中的一种或几种。向该溶液中加入溴水,单质溴被还原,由此推断该溶液中 ( )
A.含有NO3﹣,不含Fe3﹢B.含有NO3﹣、Cl﹣、I﹣
C.含I﹣,但不能确定是否含Cl﹣D.含有Fe3﹢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关用惰性电极电解AgNO3溶液一段时间后的说法正确的是
A. 电解后两极产生的气体体积比为2∶1
B. 电解过程中溶液的pH不断升高
C. 此时向溶液中加入适量的Ag2CO3固体可使溶液恢复电解前的状况
D. 电解过程中阴极质量不断减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
① H2(g) +I2(?)![]() 2HI(g) △Hl=-9.48kJ/mol
2HI(g) △Hl=-9.48kJ/mol
②H2(g) +I2(?)![]() 2HI(g) △H2=+26.48kJ/mol
2HI(g) △H2=+26.48kJ/mol
下列判断不正确的是
A. ①中的I2为气态,②中的I2为固态
B. ②的反应物总能量比①的反应物总能量低
C. 反应①的产物比反应②的产物热稳定性更好
D. lmol固态碘升华时将吸热35.96kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
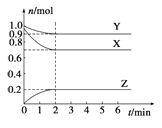
(1)该反应的化学方程式为_______________。
(2)反应开始至2min,气体Z的反应速率为_____________。
(3)若X、Y、Z均为气体,反应达平衡时:①压强是开始时的_______倍;②若此时将容器的体积缩小为原来的0.5倍,达平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为_________反应(填“放热”或“吸热”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com