某中学化学实验小组为了证明和比较SO
2与氯水的漂白性,设计了如下装置:
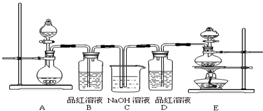
(1)实验室常用装置E制备Cl
2,指出该反应中浓盐酸所表现出的性质
酸性
酸性
,
还原性
还原性
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:
B
溶液由无色变成红色
溶液由无色变成红色
D
溶液没有明显变化
溶液没有明显变化
(3)装置C的作用是
吸收多余的SO2和Cl2,防止污染环境
吸收多余的SO2和Cl2,防止污染环境
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
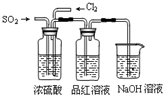
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅,试根据该实验装置和两名同学的实验结果
①指出在气体进入品红溶液之前,先将SO
2和Cl
2通过浓硫酸的两个目的
使SO2和Cl2混合均匀,
使SO2和Cl2混合均匀,
、
通过观察气泡控制气体的流速
通过观察气泡控制气体的流速
.
②试分析甲同学实验过程中,品红溶液不褪色的原因是:
控制SO2和Cl2按物质的量之比1:1进气,二者发生反应,
控制SO2和Cl2按物质的量之比1:1进气,二者发生反应,
、
生成无漂白性的H2SO4和HCl
生成无漂白性的H2SO4和HCl
,并用离子方程式表示
SO2+Cl2+2H2O=SO42-+2Cl-+4H+.
SO2+Cl2+2H2O=SO42-+2Cl-+4H+.
、
SO2+Cl2+2H2O=SO42-+2Cl-+4H+.
SO2+Cl2+2H2O=SO42-+2Cl-+4H+.
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?
控制SO2和Cl2进气的物质的量,使之不相等
控制SO2和Cl2进气的物质的量,使之不相等
.





 实验化学
实验化学 化学实验室常用甲酸(HCOOH)和浓硫酸混合加热制备一氧化碳,其反应方程式为:
化学实验室常用甲酸(HCOOH)和浓硫酸混合加热制备一氧化碳,其反应方程式为: