
【题目】Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是
A. 5 B. 4 C. 3 D. 2
科目:高中化学 来源: 题型:
【题目】下列给定条件的溶液中,一定能大量共存的离子组是
A. 无色溶液:Ca2+、H+、Cl-、HSO3-
B. 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C. FeCl2溶液:K+、Na+、SO42-、NH3·H2O
D. 常温下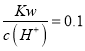 mol·L-1 的溶液:Na+、K+、SiO32-、NO3-
mol·L-1 的溶液:Na+、K+、SiO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年采用中国自主知识产权的全球首套煤基乙醇工业化项目投产成功。某地用煤制乙醇的过程表示如下。

(1)Cu(NO3)2是制备“催化剂X”的重要试剂。

①气体A是_________。
②实验室中用Cu(NO3)2固体配制溶液,常加入少量稀HNO3。运用化学平衡原理简述HNO3的作用: ________。
③NaClO溶液吸收气体A的离子方程式是_________。
(2)过程a包括以下3个主要反应:
I.CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g) △H1
C2H5OH(g)+CH3OH(g) △H1
II.CH3COOCH3(g)+C2H5OH(g)![]() CH3COOC2H5(g)+CH3OH(g) △H2
CH3COOC2H5(g)+CH3OH(g) △H2
III.CH3COOCH3(g)+H2(g)![]() CH3CHO(g)+CH3OH(g) △H3
CH3CHO(g)+CH3OH(g) △H3
相同时间内,测得CH3COOCH3转化率、乙醇和乙酸乙酯的选择性(如乙醇的选择性= ![]() )如下图所示。
)如下图所示。

①已知:△H1<0。随温度降低,反应I化学平衡常数的变化趋势是________。
②下列说法不合理的是_______。
A.温度可影响反应的选择性
B.225℃~235℃,反应I处于平衡状态
C.增大H2的浓度,可以提高CH3COOCH3的转化率
③为防止“反应III”发生,反应温度应控制的范围是____________。
④在185℃,上述反应中CH3COOCH3起始物质的量为5mol,生成乙醇的物质的量是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是主要大气污染物之一,工业上可用如图装置吸收转化SO2(A、B 为惰性电极)。下列说法错误的是( )
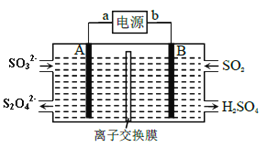
A. a为电源的正极
B. B 极上发生氧化反应
C. 离子交换膜为阳离子交换膜
D. A极区溶液的pH逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一,金属铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)基态+2价铜离子M能层电子排布式是___________;第4周期中基态原子未成对电子数与铜原子相同的元素有________种。
(2)Cu+能与SCN-形成CuSCN沉淀。请写出一种与SCN-互为等电子体的微粒_________。SCN-对应的酸有硫氰酸(H-S-CN)和异硫氰酸(H-N=C=S),这两种酸熔点更高的是_______(填名称),原因是_____________________。
(3)Cu2+能与NH3形成平面正方形的[Cu(NH3)4]2+。NH3分子的空间构型为__________;[Cu(NH3)4]2+中Cu采取dspx杂化,x的值是__________。
(4)已知Cu2O 熔点为1235 ℃,K2O 熔点为770℃,前者熔点较高,其原因是___________。
(5)Cu3N 的晶胞(立方)结构如下图所示:
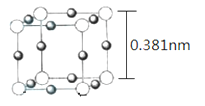
①距离最近的两个Cu+间的距离为________nm。(保留两位小数)
②Cu3N 晶体的密度为____________ g·cm-3。(NA表示阿伏伽德罗常数的值,列出计算式,不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型中温全瓷铁一空气二次电池,其结构如图所示。下列有关该电池的说法正确的是

A. 放电时O2-从a移向b B. 放电时负极的电极反应为O2+4e-=2O2-
C. 充电时1molFe 氧化为FeOx,转移2xmole- D. 充电时a 与电源的负极相连。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N 是一种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N 原子的核外电子排布式是_____________;最高能级的电子云轮廓图形状为_____________;N原子的第一电离能比O原子的大,其原因是_________________________。
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为_________。这种高聚氮N-N 键的键能为160kJ/mol,而N2 的键能为942kJ/mol,其可能潜在的应用是______________________。
(3)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,经X射线衍射测得晶体结构,其局部结构如图所示(其中N5-的立体结构是平面五元环)。下列说法正确的是________。
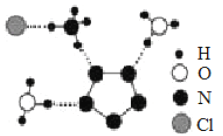
A.所有N 原子的价电子层均有孤对电子 B.两种阳离子均含有配位键
C.两种阳离子不是等电子体 D.阴阳离子之间只存在离子键
(4)NH3 与F2 反应生成NF3 和NH4F,这四种物质中,沸点由高到低的顺序是______;NF3中氮元素显_______价;属极性分子的有_________________。
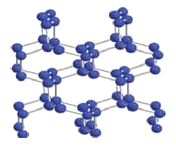
(5)立方氮化硼称为超硬材料。晶胞结构如图所示:
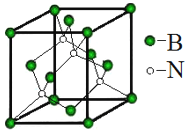
硼原子的配位数是__________。若晶胞参数为anm,则晶体的密度为____g·cm3 (用NA 表示阿伏伽德罗常数的值,列出代数式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂或分离方法不正确的是
选项 | 提纯的物质 | 除杂试剂 | 分离方法 |
A | 乙炔(硫化氢) | 硫酸铜溶液 | 洗气 |
B | 苯(苯酚) | 浓溴水 | 过滤 |
C | 乙醇(乙酸) | 生石灰 | 蒸馏 |
D | 苯甲酸(可溶性杂质) | 水 | 重结晶 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com