
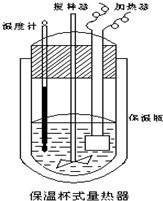
 在如图所示的量热计中,将100mL0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,两溶液的密度均近似为1g•mL-1.下列说法错误的是( )
在如图所示的量热计中,将100mL0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,两溶液的密度均近似为1g•mL-1.下列说法错误的是( )| A. | CH3COOH溶液与NaOH溶液的反应为吸热反应 | |
| B. | 所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和 | |
| C. | 若量热计的保温瓶绝热效果不好,则所测△H偏大 | |
| D. | CH3COOH的中和热△H为-53.3KJ•mol-1 |
分析 A.中和反应为放热反应;
B、酸和碱反应测中和热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,减少实验误差;
C、量热计的保温瓶绝热效果不好,热量散失;
D、先根据溶液反应放出的热量Q=-cm△T+150.5J•℃-1×△T,再根据中和热△H=-$\frac{Q}{n(H2O)}$计算即可.
解答 解:A.CH3COOH溶液与NaOH溶液的反应属于中和反应,该反应放热,故A错误;
B、过量的碱能保证CH3COOH完全被中和,从而提高实验准确度,故B正确;
C、量热计的保温瓶绝热效果不好,热量散失,△H的数值偏小,△H偏大,故C正确;
D、温度差为:2.7℃,100mL0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH溶液混合反应,生成水0.05mol,放出的热量Q=cm△t=2.7K×4.184J•g-1•℃-1×200g+150.5J•℃-1×2.7℃=2665.71J=2.67kJ,△H=-$\frac{Q}{n(H2O)}$=-$\frac{2.67kJ}{0.05mol}$=-53.3 kJ/mol,故D正确;
故选A.
点评 本题考查中和热的测定,注意掌握测定中和热的原理、操作方法以及热量计算公式的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | Na2CO3 | C. | KAl(SO4)2•12H2O | D. | CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Z)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
| A. | 若使用催化剂,则反应速率和X的转化率均增大 | |
| B. | 其他条件不变,升高温度,再达到平衡时c(Z)=0.8 mol•L-1,则△H>0 | |
| C. | 其他条件不变,容器体积压缩到1.0 L,平衡常数将增大 | |
| D. | 温度不变,向容器中再充入2 mol X、1 mol Y,反应达到新平衡时 $\frac{n(Z)}{n(Y)}$ 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 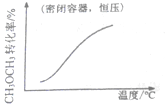 CH3OCH3(g)+3H2O(g)?6H2(g)+2CO2(g):△H>0 | B. | 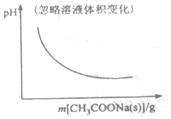 CH3COOH?H++CH3COO- | ||
| C. | 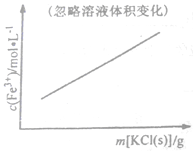 FeCl3+3KSCN?Fe(SCN)3+3KCl | D. |  N2(g)+3H2(g)?2NH3(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH),并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH),并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol OH-中含有9NA个电子 | |
| B. | 常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 | |
| C. | 1 L 1 mol/L AlCl3溶液中含有NA个Al3+ | |
| D. | 常温常压下,11.2 L甲烷气体中含有的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com