
| A. | 正极反应为4OH-═O2+2H2O+4e- | |
| B. | 放电时CO32-向负极移动 | |
| C. | 电池供应1 mol水蒸气,转移电子4 mol | |
| D. | 氢氧燃料电池的H2和O2都贮存于电池中 |
分析 A、燃料电池中,正极发生的是氧气的得电子的反应过程;
B、电池放电时,阴离子向负极移动;
C、生成1mol水转移2mol电子;
D、氢氧燃料电池的燃料不需要贮存于电池中.
解答 解:A、燃料电池中,正极发生的是氧气得电子的反应过程,电极反应为:O2+2CO2+4e-→2CO32-,故A错误;
B、电池放电时,阴离子向负极移动,则CO32- 向负极移动,故B正确;
C、已知该电池的总反应为2H2+O2═2H2O,则生成1mol水转移2mol电子,故C错误;
D、氢氧燃料电池的燃料不需要贮存于电池中,可以边反应边加,故D错误.
故选B.
点评 本题是一道有关燃料电池的工作原理的综合题目,要求学生熟悉原电池原理,把握正负极的判断方法和电极方程式的书写方法,具备分析和解决问题的能力,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 加热蒸发皿和烧杯必须垫石棉网 | |
| B. | 除去乙醇中的乙酸,加入NaOH溶液后分液 | |
| C. | 配制0.1mol•L-1NaCl溶液的实验中,用托盘天平称取5.85gNaCl | |
| D. | 将硫酸铜溶液蒸发浓缩、冷却结晶得到CuSO4•5H2O晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学中的某些元素与生命活动密不可分.请回答下列问题:
化学中的某些元素与生命活动密不可分.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
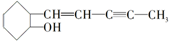 是我国科学家最近新合成的一种药物,下列关于该有机物的说法错误的是( )
是我国科学家最近新合成的一种药物,下列关于该有机物的说法错误的是( )| A. | 该有机物的分子式为C11H16O | |
| B. | 该有机物可以使溴水褪色 | |
| C. | 该有机物易溶于水 | |
| D. | 光照,该有机物可以与氯气发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人工固氮是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面能与水发生反应,生成的主要产物为NH3.相应的热化学方程式为:
人工固氮是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面能与水发生反应,生成的主要产物为NH3.相应的热化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、R元素简单离子的半径依次增大 | |
| B. | 含有Y、Z、R三种元素的化合物最多只有2种 | |
| C. | 元素W和R最高价氧化物对应水化物的酸性后者强 | |
| D. | Y与Z形成的两种化合物中的化学键类型和阴阳离子个数比均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
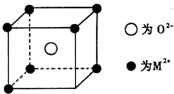 已知MO与CsCl的结构相似(如图2所示),MO晶体的密度为p g•cm-3,NA为阿伏加德罗常数,相邻的两个M2+的核间距为acm.写出Cs基态原子的价电子排布式6s1,MO的相对分子质量可以表示为ρa3 NA.
已知MO与CsCl的结构相似(如图2所示),MO晶体的密度为p g•cm-3,NA为阿伏加德罗常数,相邻的两个M2+的核间距为acm.写出Cs基态原子的价电子排布式6s1,MO的相对分子质量可以表示为ρa3 NA.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
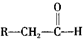 ,化学式为C8H8O2的有机物有如下的转化关系:
,化学式为C8H8O2的有机物有如下的转化关系: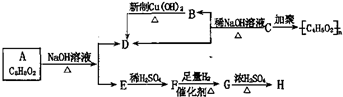
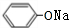 ,BCH3CHO.
,BCH3CHO.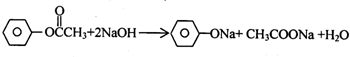 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com