
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | H2 |
| B | 胆矾 | 石灰水 | 硫酸钡 | H2CO3 | NH3 |
| C | 火碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
| D | 干冰 | 波尔多液 | 苛性钾 | 氯化氢 | 乙醇 |
| A、A | B、B | C、C | D、D |


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
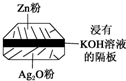 微型纽扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-═ZnO+H2O,Ag2O+H2O+2e-═2Ag+2OH-.下列叙述正确的是( )
微型纽扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-═ZnO+H2O,Ag2O+H2O+2e-═2Ag+2OH-.下列叙述正确的是( )| A、在使用过程中,电解质KOH被不断消耗 |
| B、使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C、每转移2mol e-,有232gAg2O被氧化 |
| D、Zn是负极,Ag2O是正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应的还原剂是I2 |
| B、氧化剂与还原剂的物质的量之比为5:2 |
| C、消耗lmol氧化剂,转移2mol电子 |
| D、反应后溶液的碱性明显减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO3在水中的电离:NaHSO3═Na++H++SO32- |
| B、碳酸钠水溶液的水解:CO32-+2H2O?H2CO3+2OH- |
| C、向含有Pb2+的工业废水中加入FeS:Pb2++FeS═PbS↓+Fe2+ |
| D、向硫酸铜溶液中滴加过量氨水:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 纯净物 | 混合物 | 电解质 | 非电解质 | 酸性氧化物 | |
| A | 明矾 | 漂白粉 | 胆矾 | 氯化银 | 氧化铝 |
| B | 盐酸 | 水玻璃 | 氯化钠 | 一氧化碳 | 二氧化碳 |
| C | 铁红 | 液氯 | 氧化钠 | 苯 | 二氧化碳 |
| D | 小苏打 | 铁合金 | 硫酸钡 | 乙醇 | 二氧化硅 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol、64 mol、24 mol |
| B、64 mol、2 mol、24 mol |
| C、32 mol、50 mol、12 mol |
| D、16 mol、50 mol、24 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
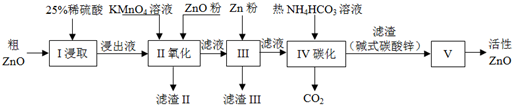
| Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
| 完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
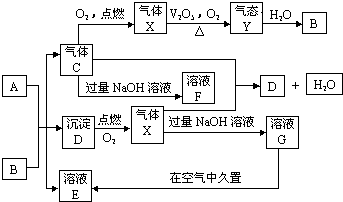
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com