
下列物质分类正确的是
A.SO2、SiO2、CO均为酸性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.烧碱、冰醋酸、四氯化碳均为电解质
D.氯水、水玻璃、氨水均为混合物
科目:高中化学 来源:2015-2016年湖南省高一下期末化学试卷(解析版) 题型:简答题
氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。,
2NH3(g) ΔH=-92.4 kJ·mol-1。,
在定容2升密闭容器中,使2 mol N2和6 mol H2混合发生反应,平衡时N2转化率为20%:
当反应达到平衡时,H2的浓度是
目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,
CO2(g)+3H2(g)  CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
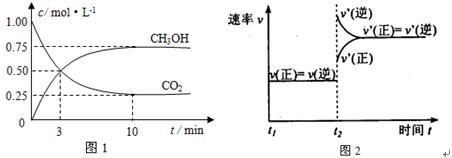
从反应开始到平衡,氢气的平均反应速率v(H2)=_________________
500℃达平衡时,CH3OH(g)的体积分数为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨六中高二下期末化学试卷(解析版) 题型:选择题
下列关于反应能量的说法正确的是
A.101kPa时,2H2(g)+O2(g)=2H2O(l) ΔH= -571.6 kJ·mol-1,H2的燃烧热为571.6 kJ·mol-1
B.Zn(s)+CuSO4(aq)=ZnSO4 (aq)+Cu(s) ΔH= -216 kJ·mol-1,反应物总能量>生成物总能量
C.H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3 kJ·mol-1,含1molNaOH的氢氧化钠的溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量。
D.相同条件下,如果1molH所具有的能量为E1,1molH2所具有的能量为E2,则2 E1= E2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江大庆实验中学高二下期末化学试卷(解析版) 题型:选择题
下列有机物的命名正确的是
A.CH3CH2CH(CH3)CH(CH3)OH :3-甲基-2-戊醇
B.CH3CH(CH3)CH=CH2:3-甲基丁烯
C.CH3CH2C(CH3)2CH3:2,2-甲基丁烷
D.CH2Cl-CH2Cl:二氯乙烷
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江大庆实验中学高二下期末化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是
A.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀
2Ba2++NH4++Al3++2SO42-+4OH-=Al(OH)3↓+NH3.H2O+2BaSO4↓
B.氨水中通入过量SO2: NH3·H2O + SO2 = HSO3- + NH4+
C.饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液:Ca2++HCO3—+OH—=CaCO3↓+H2O
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4 ↓+H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨三中高二下期末化学试卷(解析版) 题型:填空题
离子检验问题是考察元素化合物部分的重要知识点,请完成如下各离子检验所需的试剂及反应方程式。
(1)铁离子(Fe3+):试剂__________________;反应离子方程式__________________。
(2)有铁离子(Fe3+)的环境下检验是否含有亚铁离子(Fe2+):试剂: __________________,反应离子方程式__________________。
(3)硫酸根离子((SO42-):试剂__________________;反应离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨三中高二下期末化学试卷(解析版) 题型:选择题
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
X | Y | Z | |
① | NaOH溶液 | KAlO2 | 稀硫酸 |
② | KOH溶液 | NaHCO3 | 浓盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源:2015-2016学年青海乐都一中高二下期末化学试卷(解析版) 题型:填空题
目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g) CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加.
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省等校高一下期末化学试卷(解析版) 题型:选择题
绿色化学对于化学反应提出了w原子经济性。(原子节约)的新概念及要求理想的原子经济性反应是原料中的原子全部转变成所需产物不产生副产物实现零排放。下列反应为合成相应有机产物的反应原理原子利用率期望产物的总质量与生成物的总质量之比)最差的是(反应均在定条件下进行)
A.CH2=CH2 +Cl2 +Ca(OH)2→CaCl2+H2O +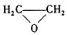
B.2CH3-CH=CH2+2NH3+3O2→2CH2=CH-CN+6H2O
C.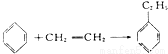
D.2CH2=CH2+O2→2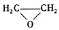
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com