
| A | ||
| B | C | D |
分析 A、B、C、D、E五种短周期元素,A、B、C、D四种元素原子核外共有56个电子,即这四种元素原子序数之和是56,设C的原子序数是x,则A的原子序数是x-8、B的原子序数是x-1、D的原子序数是x+1,
则x-8+x-1+x+x+1=56,x=16,所以A是O、B是P、C是S、D是Cl元素,
E的单质可与酸反应,1mol E单质与足量酸反应能产生22.4L H2(标准状况),则一个E原子失去2个电子,E的阳离子与A的阴离子核外电子排布完全相同,则E是Mg元素;
(1)主族元素原子核外电子层数等于其周期数、最外层电子数等于其族序数;
(2)A是O元素,在一般的化合物中显负电性,在和F元素形成的化合物中呈现正化合价;
(3)电子层结构相同的离子,离子半径随着原子序数增大而减小;
(4)D和E形成的化合物是氯化镁,一水合氨和氯化镁发生复分解反应;
(5)D的最高价氧化物的水化物是高氯酸,E的最高价氧化物的水化物是氢氧化镁,二者反应生成高氯酸镁和水.
解答 解:A、B、C、D、E五种短周期元素,A、B、C、D四种元素原子核外共有56个电子,即这四种元素原子序数之和是56,设C的原子序数是x,则A的原子序数是x-8、B的原子序数是x-1、D的原子序数是x+1,
则x-8+x-1+x+x+1=56,x=16,所以A是O、B是P、C是S、D是Cl元素,
E的单质可与酸反应,1mol E单质与足量酸反应能产生22.4L H2(标准状况),则一个E原子失去2个电子,E的阳离子与A的阴离子核外电子排布完全相同,则E是Mg元素;
(1)主族元素原子核外电子层数等于其周期数、最外层电子数等于其族序数,B是P元素,其原子核外有3个电子层、最外层电子数是5,所以位于第三周期第VA族,故答案为:第三周期第VA族;
(2)A是O元素,在一般的化合物中显负电性,在和F元素形成的化合物中呈现正化合价,故答案为:负;F;
(3)电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径大小顺序是S2->Cl-,故答案为:S2->Cl-;
(4)D和E形成的化合物是氯化镁,一水合氨和氯化镁发生复分解反应,离子方程式为Mg2++2 NH3.H2O═Mg(OH)2↓+2 NH4+,
故答案为:Mg2++2 NH3.H2O═Mg (OH)2↓+2 NH4+;
(5)D的最高价氧化物的水化物是高氯酸,E的最高价氧化物的水化物是氢氧化镁,二者反应生成高氯酸镁和水,反应方程式为Mg(OH)2+2 HClO4═Mg(ClO4)2+2 H2O,故答案为:Mg(OH)2+2 HClO4═Mg(ClO4)2+2 H2O.
点评 本题考查位置结构性质相互关系及应用,为高频考点,涉及离子半径大小比较、酸碱中和、元素在周期表中位置判断等知识点,正确判断元素是解本题关键,知道离子半径大小比较方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
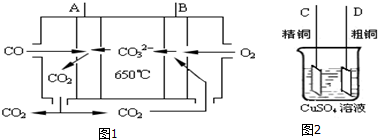
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;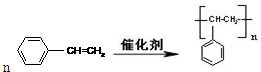 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
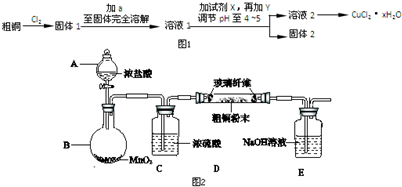
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
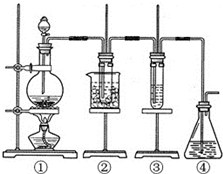 某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中:
某学习小组设计了如图所示的实验方案来制取次氯酸钠和探究氯水的性质.图中:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;E3+的离子符号为Fe3+.
;E3+的离子符号为Fe3+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
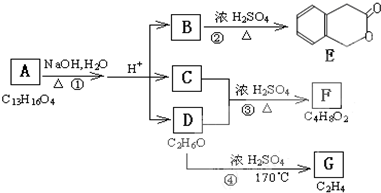
 .
. (或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).
(或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH比NaOH碱性强 | |
| B. | H3BO3的酸性比H2CO3的酸性强 | |
| C. | HCl、H2S、H3P的还原性性逐渐减弱 | |
| D. | 若M+和R2-的核外电子层结构相同,则离子半径M+>R2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com