
| A. | SO2可以使溴水褪色,所以SO2具有漂白性 | |
| B. | 因为氢氧化铁胶体具有吸附性,所以常用于净水 | |
| C. | 因为液态HCl不导电,所以HCl是非电解质 | |
| D. | NH3的水溶液可以导电,所以NH3是电解质 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
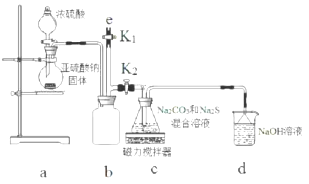
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
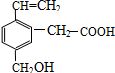 某有机物的结构为图所示,这种有机物具有的性质是( )
某有机物的结构为图所示,这种有机物具有的性质是( )| A. | ①②④ | B. | ①②③④ | C. | ②③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 3.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大c(CH3COCH3) | B. | 增大c(I2) | C. | 升高温度 | D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ②④⑥ | C. | ②③④ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com