
【题目】氧化还原反应在化学研究和工业生产中意义重大。在一定条件可发生如下两个氧化还原反应:
①Fe+ H2SO4(浓)![]() Fe2(SO4)3+ SO2↑+H2O(未配平)
Fe2(SO4)3+ SO2↑+H2O(未配平)
②3S+6KOH![]() 2K2S+ K2SO3+3H2O
2K2S+ K2SO3+3H2O
试回答下列问题:
(1)反应①中氧化产物为____________,当反应中生成标准状况下6.72LSO2气体时,被还原的H2SO4的物质的量为____________mol。
(2)反应②中,还原剂与氧化剂的物质的量之比为______________,若反应中有4.816×1023个电子发生转移时,消耗S的质量为___________________________。
【答案】Fe2(SO4)3 0.3 1:2 19.2 g
【解析】
①![]() 反应中,S元素化合价降低,被还原,H2SO4是氧化剂,生成SO2为还原产物,Fe元素化合价升高,被氧化,Fe是还原剂,生成Fe2(SO4)3为氧化产物,转移电子数为6e-,据此分析解答;
反应中,S元素化合价降低,被还原,H2SO4是氧化剂,生成SO2为还原产物,Fe元素化合价升高,被氧化,Fe是还原剂,生成Fe2(SO4)3为氧化产物,转移电子数为6e-,据此分析解答;
(2)②反应中S既是氧化剂又是还原剂,氧化剂得到还原产物K2S,还原剂得到氧化产物K2SO3;根据转移电子计算参加反应的S的质量。
(1)①![]() 反应中,Fe元素化合价升高,被氧化,Fe是还原剂,生成Fe2(SO4)3为氧化产物;S元素化合价降低,被还原,H2SO4是氧化剂,生成SO2为还原产物,则生成标准状况下6.72LSO2气体时,被还原的H2SO4有
反应中,Fe元素化合价升高,被氧化,Fe是还原剂,生成Fe2(SO4)3为氧化产物;S元素化合价降低,被还原,H2SO4是氧化剂,生成SO2为还原产物,则生成标准状况下6.72LSO2气体时,被还原的H2SO4有![]() =0.3mol,故答案为:Fe2(SO4)3;0.3;
=0.3mol,故答案为:Fe2(SO4)3;0.3;
(2)②反应中S既是氧化剂又是还原剂,氧化剂得到还原产物K2S,还原剂得到氧化产物K2SO3,由还原产物、氧化产物的化学计量数,可知反应中氧化剂与还原剂的物质的量之比为2:1;由![]() 方程式可知消耗3molS转移电子为1mol×(4-0)=4mol,所以有4.816×1023个即
方程式可知消耗3molS转移电子为1mol×(4-0)=4mol,所以有4.816×1023个即![]() =0.8mol电子发生转移时,消耗S的质量为
=0.8mol电子发生转移时,消耗S的质量为![]() ×3×32=19.2 g;故答案为:2:1;19.2 g。
×3×32=19.2 g;故答案为:2:1;19.2 g。


科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,还含有少量SiO2。现以卤块为原料按如图所示流程进行生产,用于制备金属镁。

请回答下列问题:
(1)步骤①中,为了加快酸溶速率,除了适当增加稀盐酸的浓度外,还可以采取的措施是____________(任写一条)。
(2)步骤②得到的X是___(填化学式),能够分离得到沉淀的方法是_____
(3)写出步骤④的化学方程式:_______
(4)步骤①中溶解卤块的盐酸如果过量太多造成的影响是____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着钴酸锂电池的普及使用,从废旧的钴酸锂电池中提取锂、钴等金属材料意义重大。如图是废旧钻酸锂(LiCoO2)(含少量铁、铝、铜等元素的化合物)回收工艺流程:
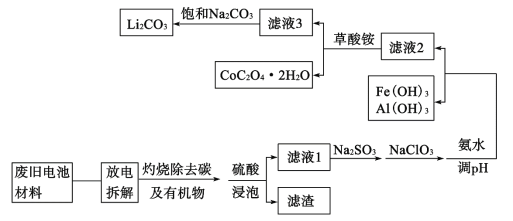
(1)“拆解”前需进入“放电”处理的目的是__;用食盐水浸泡是放电的常用方法,浸泡放电过程中产生的气体主要有__。
(2)上述流程中将CoO2-转化为Co3+的离子方程式为__。
(3)滤液1中加入Na2SO3的主要目的是__;加入NaClO3的主要目的是__。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

根据图沉钴时应控制n(C2O42-):n(Co2+)比为__,温度控制在__℃左右。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量Fe、FeO、Fe2O3的混合物中,加入50mL1mol·L-1硫酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为
A. 11.2g B. 2.8g C. 5.62g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是
A.用图1所示装置制取并收集少量纯净的氨气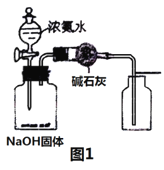
B.用图2所示装置验证木炭与浓硫酸的反应产物中含有CO2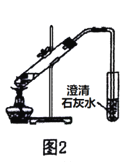
C.用图3所示装置加热分解NaHCO3固体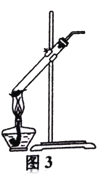
D.用图4所示装置比较KMnO4、Cl2、Br2的氧化性强弱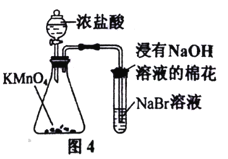
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有碳酸钠、碳酸氢钠的混合物19.0g,把它们加热到质量不再减轻,冷却后称量为15.9g。求:
(1)原混合物中碳酸钠的质量分数_________。(写出计算过程,结果保留3位有效数字)
(2)将原混合物19.0g完全溶解于蒸馏水水中,配成500mL溶液,则其中钠离子物质的量浓度为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是
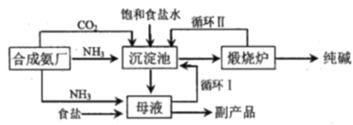
A.往母液中加入食盐的主要目的是使NaHCO3更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是Na2CO3、NH4Cl和氨水
C.沉淀池中反应的化学方程式:2NH3+CO2+2NaCl+H2O=2NH4Cl+Na2CO3
D.设计循环Ⅱ的目的是使原料二氧化碳利用率大大提升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有MgCl2,从海水中提取镁,正确的方法是
A.海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B.海水![]() MgCl2溶液→ MgCl2(熔融)
MgCl2溶液→ MgCl2(熔融)![]() Mg
Mg
C.海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D.海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液 → MgCl2(熔融)
MgCl2溶液 → MgCl2(熔融)![]() Mg
Mg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com