
”¾ĢāÄæ”æČķĆĢæóµÄÖ÷ŅŖ³É·ÖĪŖMnO2£¬»¹ŗ¬ÓŠMgO”¢CaO”¢FeO”¢Fe2O3”¢Al2O3µČŌÓÖŹ£¬¹¤ŅµÉĻÓĆČķĆĢæóÖĘČ”MnSO4”¤H2OµÄĮ÷³ĢČēĻĀ£ŗ

ŅŃÖŖ£ŗ¢Ł ¼øÖÖ³£¼ū½šŹōĄė×ÓŠĪ³ÉĒāŃõ»ÆĪļ³ĮµķŹ±µÄpHÖµČēĻĀ±ķ£ŗ
ĒāŃõ»ÆĪļ | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Mg(OH)2 |
æŖŹ¼³ĮµķpH | 7.0 | 2.7 | 3.7 | 8.1 | 9.6 |
ĶźČ«³ĮµķpH | 9.2 | 3.2 | 5.2 | 10.2 | 11 |
¢Ś ĪĀ¶ČøßÓŚ27”ꏱ£¬MnSO4µÄČܽā¶ČĖęĪĀ¶ČµÄÉżø߶ųÖš½„½µµĶ”£
£Ø1£©ŅŃÖŖ£ŗ25”ę”¢101kpaŹ±£¬
Mn(s)£«O2(g)£½MnO2(s) ”÷ H£½£520 kJ/mol
S(s)£«O2(g)£½SO2(g) ”÷ H£½£297 kJ/mol
Mn(s)£«S(s)£«2O2(g)£½MnSO4(aq) ”÷ H£½£1065 kJ/mol
”°½ž³ö”±¹ż³ĢÖŠMnO2×Ŗ»ÆĪŖMnSO4µÄČČ»Æѧ·½³ĢŹ½ĪŖ___________________________”£
£Ø2£© ”°µŚ1²½³żŌÓ”±ŹĒĪŖĮĖ³żČ„½ž³öŅŗÖŠµÄFe3+”¢Fe2+”¢Al3+£¬¼ÓČėH2O2ČÜŅŗµÄÄæµÄŹĒ£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©____________________________________________£¬ŠčŅŖµ÷½ŚµÄpHµÄ·¶Ī§ŹĒ_________________£»Ėł¼ÓµÄŹŌ¼ĮXŹĒ_________ (ĢīŅŌĻĀĪļÖŹŠņŗÅ)”£
AӢMnO2 BӢMnCO3 CӢKMnO4 DӢNaOHӣ
ĒėÓĆĘ½ŗāŅʶÆŌĄķ·ÖĪö£¬¼ÓČėXÄÜŹ¹³żČ„½ž³öŅŗÖŠFe3+µÄŌŅņŹĒ£ŗ_______________”£
£Ø3£©øł¾ŻĻĀ±ķŹż¾Ż£¬Ń”Ōń”°µŚ2²½³żŌÓ”±Ėł¼ÓµÄĪļÖŹY£ØÓÉŅ»ÖÖŃōĄė×ÓŗĶŅ»ÖÖŅõĄė×Ó×é³É£©£¬ĪļÖŹYµÄ»ÆѧŹ½____________”£
ŅõĄė×Ó Ksp ŃōĄė×Ó | CO32£ | F£ | OH£ |
Ca2+ | 5.0”Į10£9 | 1.5”Į10£10 | 4.7”Į10£6 |
Mg2+ | 3.8”Į10£6 | 7.4”Į10£11 | 5.6”Į10£12 |
Mn2+ | 2.2”Į10£11 | 5.3”Į10£3 | 2.1”Į10£13 |
£Ø4£©²ÉÓĆ”°ĻµĮŠ²Ł×÷”±ÖŠŠčŅŖ”°³ĆČČ¹żĀĖ”±£¬ĘäÄæµÄŹĒ_______________________________”£
£Ø5£©ŅŌMnSO4ČÜŅŗĪŖŌĮĻ£¬²ÉÓƵē½āµÄ·½·ØæÉÖʱøøß“æ¶ČµÄMnO2£¬Ōņµē½ā³ŲŃō¼«µÄµē¼«·“Ó¦·½³ĢŹ½ĪŖ___________________________________________________________”£
”¾“š°ø”æMnO2(s)£«SO2(g) == MnSO4(aq) ”÷H= ”Ŗ248kJ/mol-1½«2Fe2++H2O2+2H+==2Fe3++2H2O5.2£¼pH”Ü8.1B (MnCO3)ČÜŅŗÖŠŌŚŌŚĻĀĮŠĘ½ŗā£ŗFe3+ + 3H2O ![]() Fe(OH)3 + 3H+£¬¼ÓČėMnCO3ŗó£¬H+ÓėMnCO3·“Ó¦£¬Ź¹ČÜŅŗÖŠc(H+)¼õŠ”£¬Ė®½āĘ½ŗāĻņÉś³ÉFe(OH)3µÄ·½ĻņŅĘ¶Æ£¬“Ó¶ų²śÉś³ĮµķMnF2·ĄÖ¹ĪĀ¶ČĻĀ½µŹ±MnSO4”¤H2OČܽā£¬µ¼ÖĀ²śĀŹ½µµĶMn2+ - 2e- +2H2O£½MnO2 + 4H+
Fe(OH)3 + 3H+£¬¼ÓČėMnCO3ŗó£¬H+ÓėMnCO3·“Ó¦£¬Ź¹ČÜŅŗÖŠc(H+)¼õŠ”£¬Ė®½āĘ½ŗāĻņÉś³ÉFe(OH)3µÄ·½ĻņŅĘ¶Æ£¬“Ó¶ų²śÉś³ĮµķMnF2·ĄÖ¹ĪĀ¶ČĻĀ½µŹ±MnSO4”¤H2OČܽā£¬µ¼ÖĀ²śĀŹ½µµĶMn2+ - 2e- +2H2O£½MnO2 + 4H+
”¾½āĪö”æ
£Ø1£©ÓÉøĒĖ¹¶ØĀÉæÉÖŖMnO2×Ŗ»ÆĪŖMnSO4µÄČČ»Æѧ·½³ĢŹ½µÄģŹ±ä”÷H=£Ø£1065 kJ/mol+520 kJ/mol+297 kJ/mol£©=”Ŗ248kJ/mol-1£¬¹Ź“š°øĪŖ£ŗMnO2(s)£«SO2(g) == MnSO4(aq) ”÷H= ”Ŗ248kJ/mol-1£»£Ø2£©ÓɱķÖŠŹż¾ŻæÉÖŖµ±Fe2+ĶźČ«³ĮµķŹ±£¬Mn2+ŅŃæŖŹ¼³Įµķ£¬ĪŖĮĖ³żČ„ŌÓÖŹÓÖ²»Ó°ĻģMn2+£¬¹ŹŠč½«Fe2+Ńõ»Æ£»Al3+ĶźČ«³ĮµķŹ±ĖłŠčŅŖpHĪŖ5.2£¬Mn2+æŖŹ¼³ĮµķµÄpHĪŖ8.1£¬ŌņŠčµ÷ÕūpHĪŖ5.2~8.1Ö®¼ä£¬ĪŖĮĖ²»“ųČėŠĀµÄŌÓÖŹ£¬Ķ¬Ź±MnCO3ÓÖÄÜÓėH+·“Ó¦£¬Ź¹æÉÄę·“Ó¦£ŗFe3++3H2O![]() Fe(OH)3+3H+Ę½ŗāÕżĻņŅĘ¶Æ£¬“ļµ½³żČ„Fe3+µÄ×÷ÓĆ£¬¹Ź“š°øĪŖ£ŗ2Fe2++H2O2+2H+==2Fe3++2H2O£»5.2£¼pH”Ü8.1£»B £»ČÜŅŗÖŠŌŚŌŚĻĀĮŠĘ½ŗā£ŗFe3+ + 3H2O
Fe(OH)3+3H+Ę½ŗāÕżĻņŅĘ¶Æ£¬“ļµ½³żČ„Fe3+µÄ×÷ÓĆ£¬¹Ź“š°øĪŖ£ŗ2Fe2++H2O2+2H+==2Fe3++2H2O£»5.2£¼pH”Ü8.1£»B £»ČÜŅŗÖŠŌŚŌŚĻĀĮŠĘ½ŗā£ŗFe3+ + 3H2O ![]() Fe(OH)3 + 3H+£¬¼ÓČėMnCO3ŗó£¬H+ÓėMnCO3·“Ó¦£¬Ź¹ČÜŅŗÖŠc(H+)¼õŠ”£¬Ė®½āĘ½ŗāĻņÉś³ÉFe(OH)3µÄ·½ĻņŅĘ¶Æ£¬“Ó¶ų²śÉś³Įµķ£»£Ø3£©“Ó±ķÖŠŹż¾ŻæÉÖŖMnF2µÄČܶȻżŌ¶“óÓŚCaF2ŗĶMgF2£¬Ōņ¼ÓČėMnF2Äܹ»½«Ca2+ŗĶMg2+³ĮµķĶźČ«£¬¹Ź“š°øĪŖ£ŗMnF2£»£Ø4£©ĪĀ¶ČøßÓŚ27”ꏱ£¬MnSO4µÄČܽā¶ČĖęĪĀ¶ČµÄÉżø߶ųÖš½„½µµĶ£¬ĪŖ±ÜĆāŌĮĻµÄĖšŹ§£¬ŌņÓ¦³ĆČČ¹żĀĖ£¬¹Ź“š°øĪŖ£ŗ·ĄÖ¹ĪĀ¶ČĻĀ½µŹ±MnSO4”¤H2OČܽā£¬µ¼ÖĀ²śĀŹ½µµĶ£»£Ø5£©µē½āµÄŃō¼«·¢ÉśŃõ»Æ·“Ó¦£¬Mn2+±»Ńõ»ÆĪŖMnO2£¬¹Ź“š°øĪŖ£ŗMn2+ - 2e- +2H2O£½MnO2 + 4H+”£
Fe(OH)3 + 3H+£¬¼ÓČėMnCO3ŗó£¬H+ÓėMnCO3·“Ó¦£¬Ź¹ČÜŅŗÖŠc(H+)¼õŠ”£¬Ė®½āĘ½ŗāĻņÉś³ÉFe(OH)3µÄ·½ĻņŅĘ¶Æ£¬“Ó¶ų²śÉś³Įµķ£»£Ø3£©“Ó±ķÖŠŹż¾ŻæÉÖŖMnF2µÄČܶȻżŌ¶“óÓŚCaF2ŗĶMgF2£¬Ōņ¼ÓČėMnF2Äܹ»½«Ca2+ŗĶMg2+³ĮµķĶźČ«£¬¹Ź“š°øĪŖ£ŗMnF2£»£Ø4£©ĪĀ¶ČøßÓŚ27”ꏱ£¬MnSO4µÄČܽā¶ČĖęĪĀ¶ČµÄÉżø߶ųÖš½„½µµĶ£¬ĪŖ±ÜĆāŌĮĻµÄĖšŹ§£¬ŌņÓ¦³ĆČČ¹żĀĖ£¬¹Ź“š°øĪŖ£ŗ·ĄÖ¹ĪĀ¶ČĻĀ½µŹ±MnSO4”¤H2OČܽā£¬µ¼ÖĀ²śĀŹ½µµĶ£»£Ø5£©µē½āµÄŃō¼«·¢ÉśŃõ»Æ·“Ó¦£¬Mn2+±»Ńõ»ÆĪŖMnO2£¬¹Ź“š°øĪŖ£ŗMn2+ - 2e- +2H2O£½MnO2 + 4H+”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijČÜŅŗÖŠæÉÄÜŗ¬ÓŠH+”¢NH4+”¢Mg2+”¢Al3+”¢Fe3+”¢CO32£”¢SO42£”¢NO3£ÖŠµÄ¼øÖÖ”£¢ŁČō¼ÓČėŠæĮ££¬²śÉśĪŽÉ«ĪŽĪ¶µÄĘųĢ壻¢ŚČō¼ÓČėNaOHČÜŅŗ£¬²śÉś°×É«³Įµķ£¬ĒŅ²śÉśµÄ³ĮµķĮæÓė¼ÓČėNaOHµÄĪļÖŹµÄĮæÖ®¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©

A. ČÜŅŗÖŠŅ»¶Ø²»ŗ¬CO32©£¬æÉÄÜŗ¬ÓŠSO42£ŗĶNO3£
B. ČÜŅŗÖŠn(NH4+)="0.2" mol
C. ČÜŅŗÖŠµÄŃōĄė×ÓÖ»ÓŠH+”¢Mg2+”¢Al3+
D. n(H+)©Un(Al3+)©Un(Mg2+)=1©U1©U1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ĖłŹ¾,ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ(””””)


A.·“Ó¦¹ż³Ģ(1)µÄČČ»Æѧ·½³ĢŹ½ĪŖA2(g)+B2(g)C(g)¦¤H1=-Q1 kJ/mol
B.·“Ó¦¹ż³Ģ(2)µÄČČ»Æѧ·½³ĢŹ½ĪŖC(g)A2(g)+B2(g)¦¤H2=+Q2 kJ/mol
C.Q1ÓėQ2µÄ¹ŲĻµ:Q1£¾Q2
D.¦¤H2£¾¦¤H1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĄė×Ó·½³ĢŹ½ÖŠŹéŠ“ÕżČ·µÄŹĒ
A. ĻņFeCl2ČÜŅŗÖŠĶØČėCl2£ŗFe2+ + Cl2 £½ Fe3+ + 2Cl-
B. Ba(OH)2ČÜŅŗÓėĮņĖįµÄ·“Ó¦£ŗOH- + H+ £½ H2O
C. Ģ¼ĖįĒāÄĘČÜŅŗÓėNaOHČÜŅŗ·“Ó¦£ŗHCO3££«OH£ = CO32-£«H2O
D. ½«Ģś·ŪÓėĖ®ÕōĘų¹²ČČ£ŗ2Fe£«3H2O(g)![]() Fe2O3£«3H2
Fe2O3£«3H2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĀ±“śĢžŌŚKOH “¼ČÜŅŗÖŠ¼ÓČČ²»·“Ó¦µÄŹĒ ( )
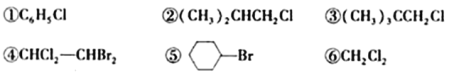
A£®¢Ł¢Ū¢Ž B£®¢Ś¢Ū¢Ż C£®Č«²æ D£®¢Ś¢Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼£¬×¶ŠĪĘæÄŚŹ¢ÓŠĘųĢåX£¬µĪ¹ÜÄŚŹ¢ÓŠŅŗĢåY”£Čō¼· Ń¹½ŗĶ·µĪ¹ÜµÄ½ŗĶ·£¬Ź¹ŅŗĢåµĪČėĘæÖŠ£¬Õńµ“£¬Ģ×ŌŚ²£Į§¹ÜŅ»¶ĖµÄŠ”ĘųĒņĀżĀż¹ÄĘš£¬ŌņĘųĢåXŗĶŅŗĢåY²»æÉÄÜŹĒ
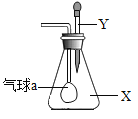
A. XŹĒCl2£¬YŹĒNaOHČÜŅŗ
B. XŹĒSO2£¬YŹĒ³ĪĒåŹÆ»ŅĖ®
C. XŹĒNO£¬YŹĒĖ®
D. XŹĒNH3£¬YŹĒĀČ»ÆÄĘČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾Ż±ķÖŠŠÅĻ¢£¬ÅŠ¶ĻĻĀĮŠŠšŹöÖŠÕżČ·µÄŹĒ
ŠņŗÅ | Ńõ»Æ¼Į | »¹Ō¼Į | ĘäĖū·“Ó¦Īļ | Ńõ»Æ²śĪļ | »¹Ō²śĪļ |
¢Ł | Cl2 | FeBr2 | / | Cl£ | |
¢Ś | KClO3 | ÅØŃĪĖį | / | Cl2 | |
¢Ū | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A£®±ķÖŠ¢Ł×éµÄ·“Ó¦æÉÄÜÓŠŅ»ÖÖ»ņĮ½ÖÖŌŖĖŲ±»Ńõ»Æ
B£®Ńõ»ÆŠŌĒæČõµÄ±Č½Ļ£ŗ KClO3£¾Fe3+£¾Cl2£¾Br2
C£®±ķÖŠ¢Ś×é·“Ó¦µÄ»¹Ō²śĪļŹĒKCl£¬µē×Ó×ŖŅĘŹżÄæŹĒ6e£
D£®±ķÖŠ¢Ū×é·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ2MnO4£+ 3H2O2 + 6H+=2Mn2+ + 4O2”ü+ 6H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēÓŅĶ¼ĖłŹ¾£¬½«SO2ĶØČėĻĀĮŠ²»Ķ¬ČÜŅŗÖŠ£¬ŹµŃéĻÖĻóÓėĖłµĆ½įĀŪ²»ÕżČ·µÄŹĒ
ČÜŅŗ | ĻÖĻó | ½įĀŪ |
| |
A | Ę·ŗģČÜŅŗ | ŗģÉ«ČÜŅŗĶŹÉ« | SO2ÓŠĘư׊Ō | |
B | H2SČÜŅŗ | ²śÉś»ĘÉ«³Įµķ | SO2ÓŠŃõ»ÆŠŌ | |
C | ĖįŠŌKMnO4ČÜŅŗ | ×ĻÉ«ČÜŅŗĶŹÉ« | SO2ÓŠĘư׊Ō | |
D | µĪÓŠ·ÓĢŖµÄNaOHČÜŅŗ | ŗģÉ«ČÜŅŗĶŹÉ« | SO2µÄĖ®ČÜŅŗ³ŹĖįŠŌ |
A. A B. B C. C D. D
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com