
| 催化剂 |
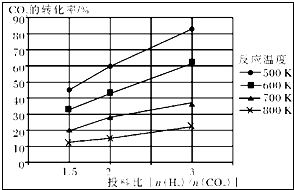
| 1 |
| 6 |
| 催化剂 |
| 0.5x |
| 1-x+3-3x+0.5x+1.5x |
| 1 |
| 6 |
| 0.8 |
| 1 |
| 催化剂 |
 .
.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
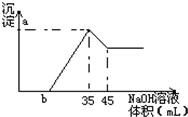 准确称取6g铝土矿(含Al2O3,Fe2O3,SiO2)样品,放入盛有100mLH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/LNaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.试求:
准确称取6g铝土矿(含Al2O3,Fe2O3,SiO2)样品,放入盛有100mLH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/LNaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.试求:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
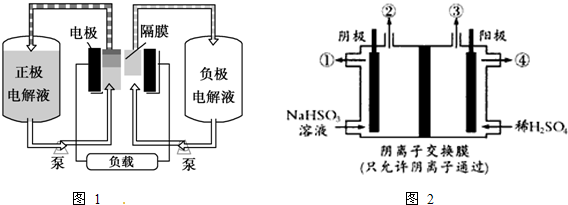
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某气体通入FeCl2溶液中 | 溶液由浅绿色变为黄色 | 该气体中一定含有Cl2 |
| B | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体中一定含有SO2 |
| C | 将某气体通过灼热的CuO粉末 | 粉末由黑变红 | 该气体中一定含有H2 |
| D | 向某溶液中滴加NaOH溶液 | 先产生白色沉淀,后沉淀溶解 | 该溶液中一定含有Al3+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| B、用碱式滴定管量取20.00mL0.1mol/LKMnO4溶液 |
| C、向沸腾的NaOH溶液中滴加FeCl3溶液,制备Fe(OH)3胶体 |
| D、配制FeSO4溶液时,需加入少量铁粉和稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质及其杂质 | 检验 | 除杂 |
| A.Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B.NaHCO3溶液(Na 2CO3) | Ca(OH)2溶液 | 过量CO2 |
| C.CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3溶液 |
| D.NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
| A、Cl2(HCl) |
| B、NaHCO3溶液(Na 2CO3) |
| C、CO2(HCl) |
| D、NO(NO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中的Na+总数增大 |
| B、溶液的碱性增强 |
| C、溶质的质量分数不变 |
| D、溶液的质量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com